
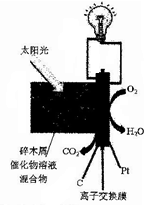
 日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )
日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )| A. | 该电池为生物质能的利用提供了一个很好的途径 | |
| B. | 该离子交换膜为质子交换膜 | |
| C. | 电源负极周围溶液的pH值升高 | |
| D. | 碎木屑发生氧化反应:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+ |
分析 以生物质为原料的低温燃料电池,生物质在负极发生氧化反应,负极反应式为:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+,从图上分析,正极上氧气反应生成水,说明离子交换膜为质子交换膜,氢离子从负极移向正极,正极反应式为:O2+4e-+4H+=2H2O,据此分析.
解答 解:A、该燃料电池能够很好地利用生物质,故A正确;
B、从图上分析,正极上氧气反应生成水,说明离子交换膜为质子交换膜,故B正确;
C、负极反应式为(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+,pH降低,故C错误;
D、生物质在负极发生氧化反应,负极反应式为(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+,故D正确;
故选C.
点评 本题考查了新型燃料电池,注意分析正负极的反应方程式是解题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
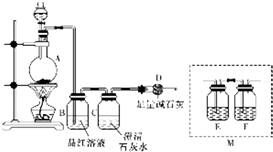 为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.
为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
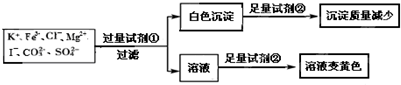
| A. | 该溶液中一定有I-、CO32-、SO42-、K+ | |
| B. | 试剂①为硝酸钡 | |
| C. | 通过黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl- | |
| D. | 试剂②一定为盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生铅中毒时,可喝大量的牛奶或鸡蛋清来缓解病情 | |
| B. | CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
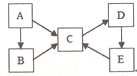 构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系:
构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Na2O2后的溶液中:K+、AlO2-、NO3-、SO32- | |
| B. | 水电离的c(H+ )=1×10-13 mol•L-1的溶液中:Fe2+、Mg 2+、SO42-、NO3- | |
| C. | 通入足量SO2后的溶液中:Ba2+、Fe2+、H2SO3、Cl- | |
| D. | 0.1mol•L-1 KMnO4酸性溶液中:H2O2、NH4+、Br2、SO4 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com