
| A. | 道尔顿 | B. | 汤姆生 | C. | 卢瑟福 | D. | 玻尔 |
分析 ①1808年,英国科学家道尔顿提出了原子论;
②1911年卢瑟福提出原子结构行星模型;
③1913年玻尔提出的量子力学模型;
④1904年汤姆生提出的葡萄干面包原子模型.
解答 解:A.1808年,英国科学家道尔顿提出了原子论,他认为物质都是由原子直接构成的;原子是一个实心球体,不可再分割,故A错误;
B.1897年,英国科学家汤姆逊发现原子中存在电子,1904年汤姆生提出了一个被称为“葡萄干面包”结构的原子结构模型,故B正确;
C.1911年英国科学家卢瑟福用一束质量比电子大很多的带正电的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,还有极少数的α粒子被反弹了回来,据此他提出了带核的原子结构模型,故C错误;
D.1913年波尔提出的量子力学模型,故D错误;
故选B.
点评 本题以原子结构的认识历史为背景,着重考查原子的结构,了解化学发展的历史是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Fe3+溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 使石蕊变红色的溶液中:K+、Fe2+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个周期和18个族 | |
| B. | 由短周期元素和长周期元素共同组成的族一定是主族 | |
| C. | 从左向右数第13列是第ⅢB族 | |
| D. | 元素周期表中0族元素的单质全部是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(HCl),将混合气体经饱和NaHSO3溶液洗气后干燥 | |
| B. | NaCl溶液(NaOH),加入适量的盐酸 | |
| C. | Na2O2粉末(Na2O),将混合物在氧气中加热 | |
| D. | FeSO4溶液[Fe2(SO4)3],加入适量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
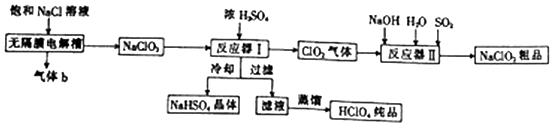
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制硅:用焦炭在高温下还原二氧化硅可制得高纯硅 | |
| B. | 工业冶炼铁:需要用到的原料有铁矿石、焦炭、空气和石灰石 | |
| C. | 工业冶炼镁:电解熔融的无水氯化镁,可以得到金属镁 | |
| D. | 工业制玻璃:将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化银是一种重要的感光材料,是胶卷中的核心成分之一 | |
| B. | 硅晶体是一种重要的半导体材料,还可用于制造光导纤维 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
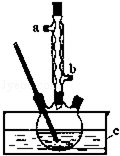 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Cu2+ | B. | Fe2+、Cu2+ | C. | Fe3+、Fe2+ | D. | Fe3+、Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com