
| ||
| 53g |
| 106g/mol |
| ||
| 53g |
| 106g/mol |
| 0.1mol |
| 0.1L |


科目:高中化学 来源: 题型:
| ||
| A、24g/mol |
| B、64g/mol |
| C、65g/mol |
| D、40g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2O含有的分子数为 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,NA 个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氢氧化钡溶液与硫酸氢钠溶液1:1混合Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从合成塔出来的混合气体,NH3的含量较小,所以生产氨的工厂的效率都很低 |
| B、由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率很高 |
| C、合成氨工业的反应温度控制在500℃,目的是使化学平衡向正反应方向移动 |
| D、合成氨厂采用的压强是20 MPa~50 MPa,因在该压强下铁触媒的活性最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中性溶液的pH都相等 |
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 |
| C、127I和131I2互为同位素 |
| D、△H<0,△S<0的化学反应不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B、原混合物一定含有Na+、Al3+、NO2- |
| C、白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D、气体乙一定是NO和NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
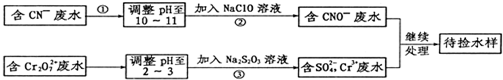
查看答案和解析>>
科目:高中化学 来源: 题型:
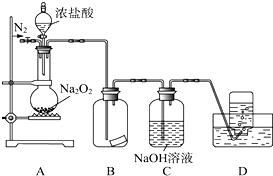 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下:
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下: Na2O2+
Na2O2+ HCl═
HCl═ Cl2+
Cl2+ NaCl+
NaCl+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com