
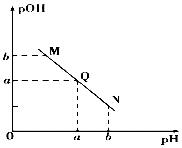
 现有①0.1mol/L NaOH溶液和②0.1mol/L HX溶液.
现有①0.1mol/L NaOH溶液和②0.1mol/L HX溶液.分析 已知:①中由水电离出的c(OH-)小于②中由水电离出的c(H+),说明①NaOH对水的抑制程度大,证明HX为弱酸,
(1)①0.1mol/L NaOH溶液和②0.1mol/L HX溶液,两溶液等体积混合得到NaX的溶液,X-离子水解溶液显碱性;
(2)碱溶液中pOH越大、pH越小,说明溶液中氢氧根离子浓度越小,氢离子浓度越大,碱性越弱、酸性越强,随着盐酸的加入,发生中和反应,溶液氢氧根离子的浓度逐渐减小,则溶液pH逐渐减小,pOH逐渐增大,结合弱电解质的电离解答该题;
(3)反应后测得溶液pH=7,则可推知NaCN过量,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Ka﹦(100a-1)×10-7 mol•L-1.
解答 解:(1)①0.1mol/L NaOH溶液和②0.1mol/L HX溶液,两溶液等体积混合得到NaX的溶液,X-离子水解溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(X-)>c(OH-)>c(H+),故答案为:c(Na+)>c(X-)>c(OH-)>c(H+);
(2)Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性.则所加NaOH溶液体积略小于HX溶液的体积,由于M点的OH-浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,
故答案为|:小于;等于;
(3)由于反应后测得溶液pH=7,当a=0.01时,恰好反应,生成了氰化氢溶液,溶液显示酸性,故氰化钠应该多些,故a>0.01;
根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-),pH=7,c(H+)=c(OH-),c(CN-)=c(Na+)-c(Cl-)=$\frac{a}{2}$mol/L-$\frac{0.01}{2}$mol/L;
再根据物料守恒:c(CN-)+c(HCN)=c(Na+)=$\frac{a}{2}$mol/L;Ka﹦$\frac{c({H}^{+})c(C{N}^{-})}{c(HCN)}$=$\frac{(\frac{a}{2}mol/L-\frac{0.01}{2}mol/L)×1{0}^{-7}mol/L}{\frac{0.01}{2}mol/L}$=(100a-1)×10-7 mol•L-1=(a-0.01)×10-5;
故答案为:>;(a-0.01)×10-5.
点评 本题考查水溶液中的离子平衡、离子浓度、电离常数、沉淀溶解平衡等电解质溶液的相关知识.考查学生的知识运用能力、灵活分析处理实际问题的能力.酸碱中和的定性判断和计算,侧重于弱电解质的电离的考查,注意弱电解质的电离特点,把握pOH的含义,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol金属钠与足量氧气反应转移的电子数为NA | |
| B. | 标准状况下,22.4L甲苯中含C-H键数目为8NA | |
| C. | 标准状况下,11.2L氦气中含有0.5NA个氦原子 | |
| D. | 常温常压下,含有NA个氮气和乙烯分子的混合气体质量为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g | B. | 5.4g | C. | 8.1g | D. | 10.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中; K+、Ba2+、AlO2-、NO3- | |
| B. | 1.0mol/L的KI溶液中:Na+、Fe3+、Cl-、SO42- | |
| C. | 与铝反应产生大量氢气的溶液中:Mg2+、HCO3-、Cl-、NO3- | |
| D. | c(H+)=1×10-13mol/L溶液中:Na+、AlO2-、SiO32-、PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol•L-1NaOH反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热充分反应,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某盐溶液呈中性,该盐不一定是强酸强碱盐 | |
| B. | 加热所有盐溶液,溶液中离子的浓度都增大 | |
| C. | 稀释盐溶液,水解常数、水解程度和离子浓度都增大 | |
| D. | NaHCO3溶液中只存在2个平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
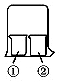 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 酚酞溶液 | 浓盐酸 | 无明显变化 |
| B | 饱和的KNO3溶液 | 浓硫酸 | 无明显变化 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com