
| m |
| M |
| m |
| M |
| 14.7g |
| 98g/mol |
| 1 |
| 2 |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白 红 白 |
| B、红 黑 红 |
| C、红 红 红 |
| D、白 黑 白 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 |
| B、若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性 |
| C、若M属于共价化合物,则该分子中原子个数比可能为1:2 |
| D、若M属于离子化合物,则该化合物中只存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
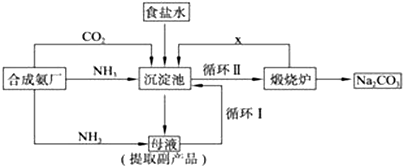
查看答案和解析>>
科目:高中化学 来源: 题型:
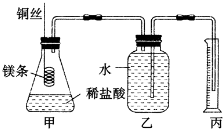
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 样品质量 | 消耗高锰酸钾 | 测定值 | 纯度 |
| g | mL | g | % | |
| 1 | 0.0514 | 5.46 | 0.0309 | 60.04 |
| 2 | 0.0479 | 5.11 | 0.0289 | 60.30 |
| 3 | 0.0522 | 6.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com