
| A. | 乙醇、1-己烯、苯酚 | B. | 正己烷、1-己醇、溴乙烷 | ||
| C. | 乙烯、丙烯、乙烷 | D. | 乙醇、乙醛、乙酸 |
分析 橙色酸性重铬酸钾溶液具有很强的氧化性,被还原后变为灰绿色,其能够氧化碳碳双键、醇羟基、醛基、苯酚等,据此分析.
解答 解:A、乙醇、1-己烯、苯酚都能够使橙色酸性重铬酸钾溶液变为灰绿色,不能鉴别,故A错误;
B、1-己醇能够使橙色酸性重铬酸钾溶液变为灰绿色,正己烷和溴乙烷不能,但正己烷的密度比水小,在溶液上层,溴乙烷的密度比水大,在溶液下层,都是无色液体,故B正确;
C、乙烯和丙烯都能够使橙色酸性重铬酸钾溶液变为灰绿色,无法鉴别,故C错误;
D、乙醇和乙醛都能够使橙色酸性重铬酸钾溶液变为灰绿色,无法鉴别,故D错误;
故选B.
点评 本题考查了有机物的鉴别,注意橙色酸性重铬酸钾溶液具有很强的氧化性,被还原后变为灰绿色,题目难度不大.


科目:高中化学 来源: 题型:填空题
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
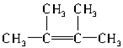 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 50% | C. | 60% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有9个横行,分为7个周期 | B. | 有7个横行,分为7个周期 | ||
| C. | 有18个纵列,分为18个族 | D. | 有16个纵列,分为16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:K>Na>Mg>N | B. | 酸性:HNO3>H3PO4>H2SiO3 | ||
| C. | 稳定性:HF<H2O<H2S | D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸性锌锰干电池是以锌筒作为负极,并经汞齐化处理,使表面性质更为均匀,以减少锌的腐蚀.正极材料是由二氧化锰粉、氯化铵及碳黑组成的一个混合糊状物.正极材料中间插入一根碳棒,作为引出电流的导体.由于酸性锰锌干电池制作简单、价格便宜,在干电池市场占有很大份额,但是他也具有一些致命的缺点;存放时间缩短,放电后电压下降较快等,因此废酸性锌猛干电池的综合利用非常重要.上图是某小型化工厂处理废干电池的流程简单示意图:
酸性锌锰干电池是以锌筒作为负极,并经汞齐化处理,使表面性质更为均匀,以减少锌的腐蚀.正极材料是由二氧化锰粉、氯化铵及碳黑组成的一个混合糊状物.正极材料中间插入一根碳棒,作为引出电流的导体.由于酸性锰锌干电池制作简单、价格便宜,在干电池市场占有很大份额,但是他也具有一些致命的缺点;存放时间缩短,放电后电压下降较快等,因此废酸性锌猛干电池的综合利用非常重要.上图是某小型化工厂处理废干电池的流程简单示意图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油和天然气都属于碳素燃料 | |
| B. | 发展太阳能经济有助于减缓温室效应 | |
| C. | 太阳能电池可将太阳能转化为电能 | |
| D. | 目前研究菠菜蛋白质“发电”不属于“太阳能文明” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com