
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
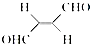 ,下列叙述正确的有AD.
,下列叙述正确的有AD.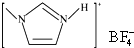 的熔点(填“>”、“=”或“<”),其原因是
的熔点(填“>”、“=”或“<”),其原因是分析 (1)同一种元素的原子,其电离能随着失电子个数的增多而增大,当原子失去电子变为稳定状态时,如果继续失电子,则其电离能会出现突兀性变化,据此判断该主族元素最外层电子数;
(2)根据基态电子排布遵循能量最低原理、泡利不相容原理和洪特规则,以此解答该题;根据主族元素的最高价等于最外层电子数;
A.Ge是一种金属元素,但最外层电子数为4,金属性不强;
B.锗单质是一种半导体材料;
C.硫的其电负性大于硅,硅的电负性大于锗;
D.组成和结构相似的分子晶体,相对分子质量越小,熔点越低;
(3)A.2-丁烯不溶于水,而该物质属于烯醛类物质;
B.C、H与C、O之间形成极性键,而C、C之间形成非极性键;
C.双键中含1个σ键和1个π键,单键均为σ键;
D.含-CHO,C=C双键,既能被氧化,又能被还原;
E.含-CHO,没有O-H键;
(4)离子化合物,且电荷数相等,离子半径大,离子键较弱,因此熔点较低;
(5)一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,据此计算.
解答 解:(1)根据元素电离能知,第三电离能和第四电离能相差较大,说明该元素原子失去3个电子时变为稳定结构,则该主族元素原子最外层有3个电子,N、Al、Si和Zn四种元素的原子中只有Al原子最外层有3个电子,则该元素是Al,
故答案为:Al;
(2)锗是32号元素,核外有32个电子,基态锗(Ge)原子原子的电子排布式为1s22s22p63s23p63d104s24p2,Ge的最高价为+4价,Ge的最高价溴化物分子式是GeBr4;
A.Ge是一种金属元素,但最外层电子数为4,金属性不强,故A错误;
B.锗单质是一种半导体材料,故B正确;
C. 硫的其电负性大于硅,硅的电负性大于锗,所以锗的电负性小于硫,故C错误;
D.氯化锗和溴化锗都是分子晶体,但氯化锗的相对分子质量小于溴化锗,所以氯化锗沸点低于溴化锗的沸点,故D正确;
故选:4s24p2;GeBr4;BD;
(3)A.2-丁烯不溶于水,而该物质属于烯醛类物质,可溶于水,则该分子在水中的溶解度大于2-丁烯,故A正确;
B.C、H与C、O之间形成极性键,而C、C之间形成非极性键,则分子中既有极性键又有非极性键,故B错误;
C.双键中含1个σ键和1个π键,单键均为σ键,则分子中有9个σ键和3个π键,故C错误;
D.-CHO能被氧化成羧基、被还原成羟基,碳碳双键,既能被酸性高锰酸钾等氧化剂氧化,又能加氢被还原,故D正确;
E.含-CHO,没有O-H键,则不能形成氢键,故E错误;
故选AD;
(4)两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低,
故答案为:>;两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低;
(5)一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键.
故答案为:2.
点评 本题考查了物质结构和性质,涉及电离能、原子的电子排布式、有机物的结构与性质、配位键等知识点,这些知识点都是考试高频点,题目难度中等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ•mol-1,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 在25°C、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ量,则表示H2燃烧热的化学方程式 2H2(g)+O2(g)═2H2O(l)△H=-571kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
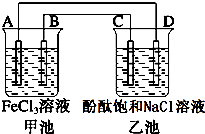 如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:
如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1:C2=1:3 | B. | 平衡时,X和Z的生成速率之比为1:2 | ||
| C. | X、Y的转化率不相等 | D. | C1的取值范围为0<C1<0.14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
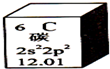 元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的三种核素质子数均为6 | B. | 该元素原子最外层有4个电子 | ||
| C. | 该元素的相对原子质量为12.01 | D. | 该元素的原子核外有三个电子层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
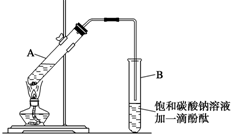 已知下表所示数据:
已知下表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com