
| A. | 冬天,块状锌与2 mol•L-1硫酸溶液反应 | |
| B. | 冬天,粉末状锌与2 mol•L-1硫酸溶液反应 | |
| C. | 夏天,块状锌与2 mol•L-1硫酸溶液反应 | |
| D. | 夏天,粉末状锌与2mol•L-1硫酸溶液反应 |
科目:高中化学 来源: 题型:选择题
| A. | 硝酸、纯碱、胆矾、铜 | B. | 硫酸、烧碱、小苏打、纯碱 | ||
| C. | 盐酸、乙醇、氯化钠、碘酒 | D. | 醋酸、漂白粉、石灰石、二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和硝基苯直接采用分液的方法分离 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在溴乙烷中加入NaOH水溶液共热,然后加入稀硝酸至呈酸性,再滴入AgNO3溶液,通过观察有无浅黄色沉淀来检验溴乙烷中的溴元素 | |
| D. | 在蔗糖溶液中加入稀硫酸共热,然后加入银氨溶液水浴加热,通过观察有无银镜生成来检验蔗糖的水解产物中有无还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol葡萄糖在酒化酶作用下水解生成2mol乙醇和2mol二氧化碳 | |
| B. | 在一定条件下CO和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 石油的重整可以提高汽油的质量和芳烃的产量 | |
| D. | 往蛋白质溶液中加入饱和硫酸钠溶液,产生的沉淀再加水又可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
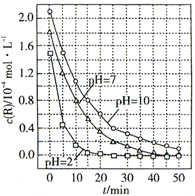
| A. | 溶液酸性越强,R的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和pH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10时R的平均降解速率为0.02 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
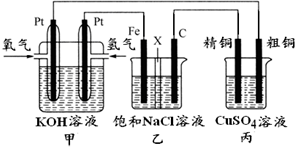
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
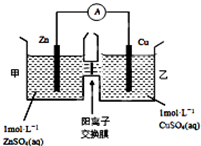 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com