
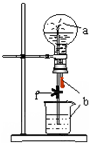
 如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是 | a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | NaNO3稀溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,说明a可溶于b或与b反应,导致烧瓶压强减小,以此解答该题.
解答 解;A.NO2与水反应,生成硝酸和NO,容器内气体减少,气压减小,形成喷泉,但由于NO不溶于水,所以不充满烧瓶.故A错误;
B.二氧化碳不溶于饱和碳酸氢钠溶液,不能充满烧瓶,故B错误;
C.Cl2不溶于饱和氯化钠溶液,也不与其反应,锥形瓶与烧瓶内压强相等,不能形成喷泉,故C错误;
D.氨气易溶于水,气体被吸收进溶液中,烧瓶内压强减小为零,同外界大气压产生压强差,所以形成喷泉,并充满烧瓶,故D正确;
故选D.
点评 本题考查喷泉实验,为高频考点,侧重于学生的分析能力的考查,注意反应物或生成物的状态变化会引起气压的变化,把握化学和物理的联系,知道解决化学问题可以应用物理知识,题目难度不大.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
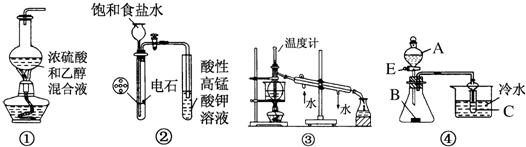
| A. | 图①用于实验室制乙烯 | |
| B. | 图②用于实验室制乙炔并验证乙炔发生氧化反应 | |
| C. | 图③用于实验室中石油的分馏 | |
| D. | 图④中若A为稀硫酸,B为纯碱(固体),C为苯酚钠溶液,则可验证硫酸、碳酸、苯酚酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和Cl2光照发生取代反应 | |
| B. | 1,3-丁二烯与等物质的量的溴发生反应 | |
| C. | 乙烯和氯化氢加成 | |
| D. | 乙醇汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
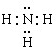 ,B的结构式为
,B的结构式为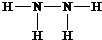 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
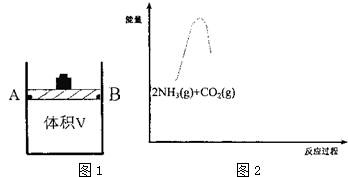
| CO2转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 30% | 65% | 75% | 75% |
| T | 45% | 50% | a1 | a2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com