
”¾ĢāÄæ”湤ŅµÖʵƵĵŖ»ÆĀĮ£ØAlN£©²śĘ·ÖŠ³£ŗ¬ÓŠÉŁĮæAl4C3”¢Al2O3”¢CµČŌÓÖŹ£®Ä³Ķ¬Ń§Éč¼ĘĮĖČēĻĀŹµŃé·Ö±š²ā¶ØµŖ»ÆĀĮ£ØAlN£©ŃłĘ·ÖŠAlNŗĶAl4C3µÄÖŹĮæ·ÖŹż£ØŗöĀŌNH3ŌŚĒæ¼īŠŌČÜŅŗÖŠµÄČܽā£©£®
£Ø1£©ŹµŃéŌĄķ£ŗ¢ŁAl4C3ÓėĮņĖį·“Ó¦æÉÉś³ÉCH4£»¢ŚAlNČÜÓŚĒæĖį²śÉśļ§ŃĪ£¬ČÜÓŚĒæ¼īÉś³É°±Ęų£®Š“³öAl4C3ÓėĮņĖį·“Ó¦µÄ»Æѧ·½³Ģ £®
£Ø2£©ŹµŃé×°ÖĆ£ØČēĶ¼ĖłŹ¾£©£ŗ

£Ø3£©ŹµŃé¹ż³Ģ£ŗ
¢ŁĮ¬½ÓŹµŃé×°ÖĆ£¬¼ģŃé×°ÖƵÄĘųĆÜŠŌ£®³ĘµĆD×°ÖƵÄÖŹĮæĪŖyg£¬µĪ¶Ø¹ÜµÄ¶ĮŹżĪŖamL£»
¢Ś³ĘČ”xgAlNѳʷÖĆӌװÖĆBĘæÖŠ£»ČūŗĆ½ŗČū£¬¹Ų±Õ»īČūK2”¢K3£¬“ņæŖ»īČūK1£¬Ķعż·ÖŅŗĀ©¶·¼ÓČėĻ”ĮņĖį£¬Óė×°ÖĆBĘæÄŚĪļÖŹ³ä·Ö·“Ó¦£»
¢Ū“ż·“Ó¦½ųŠŠĶźČ«ŗ󣬹Ų±Õ»īČūK1£¬“ņæŖ»īČūK3£¬Ķعż·ÖŅŗĀ©¶·¼ÓČė¹żĮæNaOH£¬Óė×°ÖĆBĘæÄŚĪļÖŹ³ä·Ö·“Ó¦£»
¢Ü £ØĢīČėøĆ²½Ó¦½ųŠŠµÄ²Ł×÷£©£»
¢Ż¼ĒĀ¼µĪ¶Ø¹ÜµÄ¶ĮŹżĪŖbmL£¬³ĘµĆD×°ÖƵÄÖŹĮæĪŖzg£®
£Ø4£©Źż¾Ż·ÖĪö£ŗ£ØŅŃÖŖ£ŗøĆŹµŃéĢõ¼žĻĀµÄĘųĢåĦ¶ūĢå»żĪŖVm Lmol©1£©
¢ŁAl4C3µÄÖŹĮæ·ÖŹżĪŖ £»
¢ŚČō¶ĮČ”µĪ¶Ø¹ÜÖŠĘųĢåµÄĢå»żŹ±£¬ŅŗĆę×óøßÓŅµĶ£¬ŌņĖł²āĘųĢåµÄĢå»ż £ØĢī”°Ę«“ó”±”¢”°Ę«Š””±»ņ”°ĪŽÓ°Ļģ”±ĻĀĶ¬£©£®Čō·ÖŅŗĀ©¶·ŗĶĪüĀĖĘæ¼äƻӊÓĆĻš½ŗ¹ÜĮ¬ĶØ£¬ŌņĖł²āĘųĢåµÄĢå»ż £»
¢ŪAlNµÄÖŹĮæ·ÖŹżĪŖ £®
”¾“š°ø”æ£Ø1£©AlN+NaOH+H2O=NaAlO2+NH3”ü£»
£Ø3£©“ņæŖK2£¬ĶØČėæÕĘųŅ»¶ĪŹ±¼ä£»
£Ø4£©¢Ł![]() ”Į100%£®
”Į100%£®
¢ŚĘ«Š”£»Ę«“ó£»
¢Ū![]() ”Į100%£®
”Į100%£®
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ“ÓŹµŃé×°ÖĆŗĶŹµŃé²½ÖčÉĻæ“£¬±¾ŹµŃéµÄŌĄķŹĒÓĆ×ćĮæĮņĖįÓėѳʷ֊Al4C3ĶźČ«·“Ó¦£¬ĮæȔɜ³ÉµÄ¼×ĶéĘųĢ壬“Ó¶ųæɲāµĆAl4C3µÄ°Ł·Öŗ¬Į棻ÓĆ×ćĮæNaOHČÜŅŗÓėѳʷ֊AlNĶźČ«·“Ó¦£¬³ä·ÖĪüŹÕÉś³ÉµÄ°±Ęų£¬²¢³ĘĮæĘäÖŹĮ棬“Ó¶ųĒóµĆAlNµÄÖŹĮæ·ÖŹż£¬ŅŌ“Ė·ÖĪö½ā“š£»
£Ø1£©¢Śøł¾ŻĢāÄæŠÅĻ¢£ŗAlNČÜÓŚĒæ¼īČÜŅŗŹ±»įÉś³ÉNH3Ą“ŹéŠ“·½³ĢŹ½£»
£Ø3£©¢Ü×°ÖĆÖŠ²ŠĮō²æ·Ö°±Ęų£¬“ņæŖK2£¬ĶØČėæÕĘųŅ»¶ĪŹ±¼ä£¬Åž”×°ÖƵݱĘų£¬±»×°ÖĆDĶźČ«ĪüŹÕ£»
£Ø4£©¢Łøł¾ŻµŖŌ×ӵďŲŗć£¬°±ĘųµÄĪļÖŹµÄĮæµČÓŚAlNµÄĪļÖŹµÄĮ棬æÉĒóµĆAlNµÄÖŹĮæ·ÖŹż£»
¢Ś¶ĮČ”µĪ¶Ø¹ÜÖŠĘųĢåµÄĢå»żŹ±£¬ŅŗĆę×óøßÓŅµĶ£¬ĘųĢåµÄŃ¹Ēæ“óÓŚ“óĘųŃ¹£¬²ā¶ØĘųĢå¼×ĶéµÄĢå»żĘ«Š”£»Čē¹ū×°ÖĆƻӊĻš½ŗ¹Ü£¬ĖęŅŗĢåĮ÷ĻĀŹŌ¹ÜÖŠŃ¹ĒæŌö“ó£¬ŌŚÅÅŅŗ¹ż³ĢÖŠ»įÅųöµÄŅŗĢåŌö¶ą£¬µ¼ÖĀ²ā¶Ø½į¹ūĘ«øߣ»
¢Ūøł¾ŻĢ¼Ō×ӵďŲŗć£¬Al4C3µÄĪļÖŹµÄĮæµČÓŚ¼×ĶéµÄĪļÖŹµÄĮæµÄČż·ÖÖ®Ņ»£¬æÉĒóµĆAl4C3µÄÖŹĮæ·ÖŹż£®
½ā£ŗ“ÓŹµŃé×°ÖĆŗĶŹµŃé²½ÖčÉĻæ“£¬±¾ŹµŃéµÄŌĄķŹĒÓĆ×ćĮæĮņĖįÓėѳʷ֊Al4C3ĶźČ«·“Ó¦£¬ĮæȔɜ³ÉµÄ¼×ĶéĘųĢ壬“Ó¶ųæɲāµĆAl4C3µÄ°Ł·Öŗ¬Į棻ÓĆ×ćĮæNaOHČÜŅŗÓėѳʷ֊AlNĶźČ«·“Ó¦£¬³ä·ÖĪüŹÕÉś³ÉµÄ°±Ęų£¬²¢³ĘĮæĘäÖŹĮ棬“Ó¶ųĒóµĆAlNµÄÖŹĮæ·ÖŹż£»
£Ø1£©øł¾ŻĢāÄæŠÅĻ¢£ŗAlNČÜÓŚĒæ¼īČÜŅŗŹ±»įÉś³ÉNH3£¬»Æѧ·½³ĢŹ½ĪŖ£ŗAlN+NaOH+H2O=NaAlO2+NH3”ü£¬
¹Ź“š°øĪŖ£ŗAlN+NaOH+H2O=NaAlO2+NH3”ü£»
£Ø3£©¢Ü×°ÖĆÖŠ²ŠĮō²æ·Ö°±Ęų£¬“ņæŖK2£¬ĶØČėæÕĘųŅ»¶ĪŹ±¼ä£¬Åž”×°ÖƵݱĘų£¬±»×°ÖĆDĶźČ«ĪüŹÕ£¬·ĄÖ¹²ā¶ØµÄ°±ĘųµÄÖŹĮæĘ«Š”£¬
¹Ź“š°øĪŖ£ŗ“ņæŖK2£¬ĶØČėæÕĘųŅ»¶ĪŹ±¼ä£»
£Ø4£©¢Ł¼×ĶéµÄĢå»żĪŖ£Øa©b£©mL£¬ĪļÖŹµÄĮæĪŖ![]() mol£¬øł¾ŻĢ¼Ō×ӵďŲŗć£¬Al4C3µÄĪļÖŹµÄĮæµČÓŚ¼×ĶéµÄĪļÖŹµÄĮæµÄČż·ÖÖ®Ņ»£¬ĖłŅŌAl4C3µÄÖŹĮæĪŖ
mol£¬øł¾ŻĢ¼Ō×ӵďŲŗć£¬Al4C3µÄĪļÖŹµÄĮæµČÓŚ¼×ĶéµÄĪļÖŹµÄĮæµÄČż·ÖÖ®Ņ»£¬ĖłŅŌAl4C3µÄÖŹĮæĪŖ![]() ”Į
”Į![]() mol”Į144g/mol=
mol”Į144g/mol=![]() g£¬Al4C3µÄÖŹĮæ·ÖŹżĪŖ
g£¬Al4C3µÄÖŹĮæ·ÖŹżĪŖ![]() ”Į100%£¬
”Į100%£¬
¹Ź“š°øĪŖ£ŗ![]() ”Į100%£®
”Į100%£®
¢Ś¶ĮČ”µĪ¶Ø¹ÜÖŠĘųĢåµÄĢå»żŹ±£¬ŅŗĆę×óøßÓŅµĶ£¬ĘųĢåµÄŃ¹Ēæ“óÓŚ“óĘųŃ¹£¬²ā¶ØĘųĢå¼×ĶéµÄĢå»żĘ«Š”£¬Ļš½ŗ¹ÜæÉŅŌĘ½ŗāŃ¹ĒæČĆŅŗĢåĖ³ĄūµĪČėŹŌ¹ÜÖŠ£¬»¹æÉŅŌĘšµ½½µµĶŹµŃéĪó²īµÄ×÷ÓĆ£¬Čē¹ū×°ÖĆ֊ƻӊĻš½ŗ¹Ü£¬ĖęŅŗĢåĮ÷ĻĀŹŌ¹ÜÖŠŃ¹ĒæŌö“ó£¬ŹŌ¹ÜÖŠÅųöŅŗĢåŌö¶ą£¬²āĮæ³öµÄøĆĪļÖŹ°Ł·Öŗ¬Į潫»įĘ«“ó£¬
¹Ź“š°øĪŖ£ŗĘ«Š”£»Ę«“ó£»
¢Ū°±ĘųµÄÖŹĮæĪŖ£Øz©y£©g£¬ĪļÖŹµÄĮæĪŖ![]() mol£¬øł¾ŻµŖŌ×ӵďŲŗć£¬°±ĘųµÄĪļÖŹµÄĮæµČÓŚAlNµÄĪļÖŹµÄĮ棬ĖłŅŌAlNµÄÖŹĮæĪŖ
mol£¬øł¾ŻµŖŌ×ӵďŲŗć£¬°±ĘųµÄĪļÖŹµÄĮæµČÓŚAlNµÄĪļÖŹµÄĮ棬ĖłŅŌAlNµÄÖŹĮæĪŖ![]() mol”Į41g/mol=
mol”Į41g/mol=![]() g£¬¹ŹAlNµÄÖŹĮæ·ÖŹżĪŖ
g£¬¹ŹAlNµÄÖŹĮæ·ÖŹżĪŖ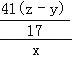 ”Į100%=
”Į100%=![]() ”Į100%£¬
”Į100%£¬
¹Ź“š°øĪŖ£ŗ![]() ”Į100%£®
”Į100%£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½ųŠŠ»ÆѧŹµŃé±ŲŠė×¢Ņā°²Č«£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄ×éŗĻŹĒ( )
¢ŁµćČ¼ĒāĘųĒ°ŅŖ¼ģŃéĒāĘųµÄ“æ¶Č£¬ŅŌĆā·¢Éś±¬ÕØ ¢ŚCOĘųĢåÓŠ¶¾£¬“¦ĄķCOĘųĢåŹ±æɽ«ĘäµćČ¼£¬×Ŗ»ÆĪŖĪŽ¶¾µÄCO2 ¢ŪŌŚŹ¢O2µÄ¼ÆĘųĘæÖŠ½ųŠŠĢśĖæČ¼ÉÕŹµŃ鏱£¬ŹĀĻČŌŚ¼ÆĘųĘæµ×²æĘĢÉĻŅ»²ćɳ×Ó ¢ÜÓĆĒāĘų»¹ŌŃõ»ÆĶŹ±£¬ĻČ¼ÓČČŌŁĶØČėĒāĘų£¬ŅŌĆāĄĖ·ŃĒāĘų ¢ŻĻ”ŹĶÅØĮņĖįµÄ²Ł×÷ČēĻĀĶ¼ĖłŹ¾

A£®¢Ł¢Ś¢Ū¢Ü B£®¢Ł¢Ś¢Ū C£®¢Ł¢Ś¢Ü D£®¢Ł¢Ś¢Ū¢Ü¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»øöĆܱÕČŻĘ÷£¬ÖŠ¼äÓŠŅ»æÉ×ŌÓÉ»¬¶ÆµÄøō°å£Øŗń¶ČæÉŗöĀŌ£©½«ČŻĘ÷·Ö³ÉĮ½²æ·Ö£¬µ±×ó±ß³äČė1molN2£¬ÓŅ±ß³äČėCOŗĶCO2µÄ»ģŗĻĘųĢå¹²8gŹ±£¬øō°å“¦ÓŚČēĶ¼Ī»ÖĆ£Ø×ó”¢ÓŅĮ½²ąĪĀ¶ČĻąĶ¬£©£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
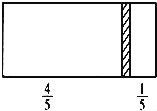
A£®ÓŅ±ßCOÓėCO2·Ö×ÓŹżÖ®±ČĪŖ1£ŗ3
B£®ÓŅ²ąĘųĢåĆܶȏĒĻąĶ¬Ģõ¼žĻĀĒāĘųĆܶȵÄ18±¶
C£®ÓŅ²ąCOµÄÖŹĮæĪŖ1.75g
D£®Čōøō°å“¦ÓŚ¾ąĄėÓŅ¶Ė![]() “¦£¬ĘäĖūĢõ¼ž²»±ä£¬ŌņĒ°ŗóĮ½“ĪŃ¹ĒæÖ®±ČĪŖ25£ŗ24
“¦£¬ĘäĖūĢõ¼ž²»±ä£¬ŌņĒ°ŗóĮ½“ĪŃ¹ĒæÖ®±ČĪŖ25£ŗ24
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŖĖŲÖÜĘŚ±ķŹĒѧĻ°»ÆѧµÄÖŲŅŖ¹¤¾ß£¬ĖüŅžŗ¬×ÅŠķ¶ąŠÅĻ¢ŗĶ¹ęĀÉ£®ĻĀ±ķĖłĮŠŹĒĪåÖÖ¶ĢÖÜĘŚµÄŌ×Ó°ė¾¶¼°Ö÷ŅŖ»ÆŗĻ¼Ū£ØŅŃÖŖīėµÄŌ×Ó°ė¾¶ĪŖ0.089nm£©
ŌŖĖŲ“śŗÅ | A | B | C | D | E |
Ō×Ó°ė¾¶/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
Ö÷ŅŖ»ÆŗĻ¼Ū | +2 | +3 | +6”¢©2 | ©1 | ©2 |
£Ø1£©AŗĶEĮ½ŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļµÄµē×ÓŹ½ £®
£Ø2£©BµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļÓėCµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ
£Ø3£©ÉĻŹöĪåÖÖŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌ×īĒæµÄŹĒ £ØĢī»ÆѧŹ½£©
£Ø4£©CŗĶEŠĪ³ÉµÄ»ÆŗĻĪļÖŠ¾ßÓŠ»¹ŌŠŌµÄŹĒ £ØĢī»ÆѧŹ½£©£®
£Ø5£©AŗĶDĖłŠĪ³É»ÆŗĻĪļµÄ¾§ĢåĄąŠĶ£ŗ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆŗĻĪļ·Ö×ÓÖŠ²»ŗ¬Ė«¼ü½į¹¹µÄŹĒ£Ø £©
A£®ŅŅ“¼ B£®¶žŃõ»ÆĢ¼ C£®ŅŅĖį D£®ŅŅČ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠĖȤŠ”×é²ÉÓĆHgSO4×÷“߻ƼĮ£¬Ź¹ŅŅČ²Ė®»ÆĪŖŅŅČ©£ØŌŚ75”ę×óÓŅ£©”£µ«HgSO4Óöµ½Ä³Š©ĢŲ¶ØĪļÖŹ³£»į·¢Éś“߻ƼĮÖŠ¶¾¶ųŹ§Č„“ß»Æ×÷ÓĆ£¬H2S¾ĶŹĒĘäÖŠŅ»ÖÖ”£ĻÖŃ”ÓĆæéדµēŹÆ”¢ÅØĮņĖį”¢Ė®”¢NaOHČÜŅŗ”¢HgO·ŪÄ©ĪåÖÖĪļÖŹÖĘŅŅČ©£¬×°ÖĆĶ¼ČēĻĀĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
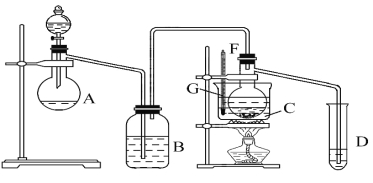
£Ø1£©ŹµŃéæŖŹ¼Ź±£¬ŅĒĘ÷AÖŠŹ¢·ÅµēŹÆ£¬B֊ӦװČė________£¬Ęä×÷ÓĆŹĒ___________”£
£Ø2£©ŅĒĘ÷DÖŠŹ¢·ÅĖ®£¬Ęä×÷ÓĆŹĒ_________”£
£Ø3£©ÕōĮóÉÕĘæFÖŠÓ¦¼ÓČėHgOŗĶĮķĶāĮ½ÖÖŹŌ¼Į£¬Čō½«ČżÕß·Ö±šÖ±½Ó¼ÓČė£¬Ēė°“¼ÓČėµÄĻČŗóĖ³ŠņŠ“³ö°üĄØHgOŌŚÄŚµÄø÷ÖÖŹŌ¼ĮµÄĆū³Ę__________”£
£Ø4£©ĖłŃ”ÓĆĪĀ¶Č¼ĘGµÄĮæ³Ģ±ķŹ¾ÕżČ·µÄŹĒ________”£
A£®0”«50”ę B£®0”«100”ę
C£®0”«200”ę D£®50”«100”ę
£Ø5£©¼ģŃéŅŅČ©ŅŃÖĘ³öµÄ²Ł×÷”¢ĻÖĻóŹĒ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÖŠ£¬²»ÕżČ·µÄŹĒ£Ø £©
A£®H”¢D”¢T»„ĪŖĶ¬Ī»ĖŲ
B£®NaHCO3”¢HCOONa¾łŗ¬ÓŠĄė×Ó¼üŗĶ¹²¼Ū¼ü
C£®³£ĪĀ³£Ń¹ĻĀ£¬22.4 L CCl4ŗ¬ÓŠNAøöCCl4·Ö×Ó
D£®³£ĪĀĻĀ£¬23 g NO2ŗ¬ÓŠNAøöŃõŌ×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ1molij±„ŗĶĶéĢžŌŚŃõĘųÖŠ³ä·ÖČ¼ÉÕ£¬ŠčŅŖĻūŗÄŃõĘų246.4L£Ø±ź×¼×“æöĻĀ£©£®ĖüŌŚ¹āÕÕµÄĢõ¼žĻĀÓėĀČĘų·“Ó¦ÄÜÉś³É3ÖÖ²»Ķ¬µÄŅ»ĀČČ”“śĪļ£®øĆĢžµÄ½į¹¹¼ņŹ½ŹĒ£Ø £©
A£®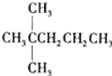
B£®CH3CH2CH2CH2CH3
C£®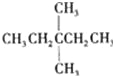
D£®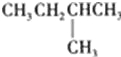
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆŹÆÄ«µē¼«µē½ā1 molL -1 µÄĻĀĮŠČÜŅŗ£¬ČÜŅŗµÄpH²»±äµÄŹĒ£Ø £©
A£®HCl B£®NaOH C£®Na2SO4 D£®NaCl
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com