
| A. | 1:1 | B. | 2:3 | C. | 3:4 | D. | 5:6 |
分析 由电子守恒:n(Co3+)=2 n(Cl2),由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-),联立计算n氧化物(Co2+),根据化合价电荷守恒为0计算氧化物中n(O),进而计算氧化物中n(Co):n(O).
解答 解:由电子守恒:n(Co3+)=2 n(Cl2)=2×$\frac{4.48L}{22.4L/mol}$=0.4 mol,
由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×( 0.48L×5mol/L-2×$\frac{4.48L}{22.4L/mol}$)=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,
根据化合价电荷守恒为0,氧化物中n(O)=(0.6mol×2+0.4mol×3)÷2=1.2mol,
故该钴氧化物中n(Co):n(O)=1mol:1.2mol=5:6,
故选:D.
点评 本题考查了氧化还原反应的有关计算,侧重于电子守恒在计算中应用的考查,题目难度中等,考查了学生的计算能力和分析能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O,取代反应.
+3H2O,取代反应. ,加聚反应(或聚合反应).
,加聚反应(或聚合反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

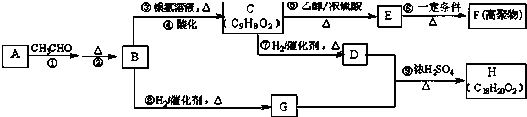
 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$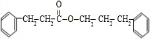 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石、石英和足球烯均为空间网状结构的原子晶体 | |
| B. | 在NaOH、NH4Cl和Na2S04中,都存在离子键和共价键 | |
| C. | 干冰升华的过程只需克服分子间作用力 | |
| D. | H20分解生成H2和O2的过程中既有共价键断裂,又有共价键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com