
不能说明X的电负性比Y的大的是( )
|
| A. | 与H2化合时X单质比Y单质容易 |
|
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
|
| C. | X原子的最外层电子数比Y原子的最外层电子数多 |
|
| D. | X单质可以把Y从其氢化物中置换出来 |
考点:
元素电离能、电负性的含义及应用.
专题:
原子组成与结构专题.
分析:
A、电负性越大的元素其吸引电子的能力越强,和氢气化合越容易;
B、电负性越强的元素其最高价含氧酸的酸性越强;
C、元素电负性大小与吸引电子能力有关,与最外层电子数无关;
D、电负性越强的元素其吸引电子能力越强,其单质的氧化性越强.
解答:
解:A、电负性越大的元素其单质得电子能力越强即氧化性越强,和氢气化合越容易,所以与H2化合时X单质比Y单质容易能说明X比Y的电负性大,故A正确;
B、电负性越强的元素其单质得电子能力越强,其最高价含氧酸的酸性越强,X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强能说明X比Y的电负性大,故B正确;
C、元素电负性大小与吸引电子能力有关,与最外层电子数多少无关,如氧元素的电负性比碘元素的电负性大,但氧原子最外层电子数小于碘原子最外层电子数,所以X原子的最外层电子数比Y原子的最外层电子数多不能说明X比Y的电负性大,故C错误;
D、电负性越强的元素其吸引电子能力越强,其单质的氧化性越强,X单质可以把Y从其氢化物中置换出来能说明X比Y的电负性大,故D正确;
故选C.
点评:
本题考查了元素电负性大小的判断,元素电负性大小与其吸引电子能力有关,与其最外层电子数多少无关.


科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是()
A. 28g以任意比组成的CO与N2混合气体中含有原子数为2NA
B. 22.4L H2中含有氢原子的个数为2NA
C. 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移4NA个电子
D. 1L 1 mol/L 的盐酸中有NA 个HCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是()
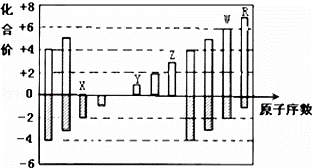
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应式:(1)2Fe3++2I﹣=2Fe2++I2,(2)Br2+2Fe2+=2Fe3++2Br﹣,判断下列离子的还原性由强到弱的顺序是()
A. Br﹣、Fe2+、I﹣ B. I﹣、Fe2+、Br﹣ C. Br﹣、I﹣、Fe2+ D. Fe2+、I﹣、Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
A﹣H分别是中学化学中的常见物质,它们之间有下图所示关系(反应中所需要和所生成的水均没有列出),已知B、H为常见的金属单质,A、C均为气体单质且A气体的颜色为黄绿色,F的水溶液为蓝色,B、D、G、E中均含同一种元素.请回答:
(1)A、B、G、H分别是什么物质?(写物质名称)
A ,B铁,G ,H
(2)写出D→F反应的离子方程式: .
(3)写出G和稀盐酸反应的化学方程式: .
(4)2molB与足量的A完全反应生成D时所转移的电子为 mol.
(5)如何检验D溶液中的阳离子? .

查看答案和解析>>
科目:高中化学 来源: 题型:
三氯化氮(NCl3)常温是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3的说法中正确的是( )
|
| A. | 它是一种非极性分子 |
|
| B. | 它能以配位键与Cl﹣结合,生成NCl4﹣ |
|
| C. | NCl3中N原子采用SP2杂化 |
|
| D. | 已知NCl3中N元素为﹣3价,所以NCl3水解产物为NH3和HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”.以下有关主族元素原子的“未成对电子”的说法,错误的是( )
|
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” |
|
| B. | 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” |
|
| C. | 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” |
|
| D. | 核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子” |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
| a |
| ||||||||||||||||
| b | c | d | e | f |
| ||||||||||||
| g | h | i | j | k | l | m |
| ||||||||||
| n | o |
试回答下列问题:
(1)请写出字母O代表的元素符号 ,该元素在周期表中的位置 .
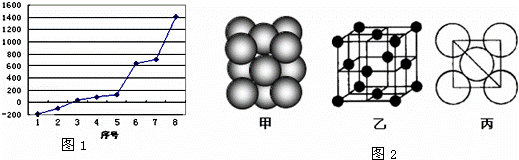
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填如图1中的序号).
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是 (填化学式),试从结构角度加以解释: .
(4)k与l形成的化合物kl2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体.
(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为 ,该晶体的密度_ (用M、NA、d表示).
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质与常用危险化学品的类别不对应的是()
A. CH4、汽油﹣易燃液体 B. H2SO4、NaOH﹣腐蚀品
C. K、Na﹣遇湿易燃物品 D. KMnO4、K2Cr2O2﹣氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com