
| A. | 炭在常温下化学性质不活泼,因此在埋木桩前,可将埋入地下的一段表面用火微微烧焦 | |
| B. | 可用NaOH溶液除去MgCl2溶液中少量的FeCl3 | |
| C. | 足量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++2H2O+NO↑ | |
| D. | 向某溶液滴加盐酸酸化的氯化钡溶液,出现白色沉淀,则证明该溶液中含有SO42- |
分析 A、常温下,碳的性质较稳定,木桩烧焦变为碳,据此分析;
B、FeCl3易水解生成氢氧化铁,加入Mg(OH)2粉末、MgO或MgCO3,调节溶液的pH,促进铁离子的水解,且不引入新的杂质;
C、铁中量生成亚铁离子,所以反应的化学方程式为:3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O;
D、加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该沉淀可能为BaSO4或AgCl.
解答 解:A、在埋木桩前,可将埋入地下的一段表面用火微微烧焦,使其变为碳,炭在常温下化学性质不活泼,故A正确;
B、FeCl3易水解生成氢氧化铁,加入Mg(OH)2粉末、MgO或MgCO3,调节溶液的pH,促进铁离子的水解,且不引入新的杂质,加入氢氧化钠引入钠离子,故B错误;
C、铁中量生成亚铁离子,所以反应的化学方程式为:3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O,所以离子反应为:3Fe+8H++2NO3-═Fe2++4H2O+2NO↑,故C错误;
D、加入盐酸酸化的氯化钡溶液,有白色沉淀生成,溶液中可能存在Ag+或SO42-,故D错误;
故选:A.
点评 本题主要考查了除杂、离子的检验和离子反应方程式的书写,其中盐类的水解可用于除杂,除杂时不能引入新杂质,有一定的难度.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 干冰可用作致冷剂 | B. | 在铁制容器表面刷铝粉可防止生锈 | ||
| C. | 氢氧化钠可用作医用胃酸中和剂 | D. | 过氧化钠可用作供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某工业废水中含有CN-和Cr2O${\;}_{7}^{2-}$等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
某工业废水中含有CN-和Cr2O${\;}_{7}^{2-}$等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3═K++Cl-+3O2- | B. | H2SO4═2H++SO42- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | Na2SO4═2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p/400 mol•L-1 | B. | 20 p mol•L-1 | C. | 1.25 p mol•L-1 | D. | 2.5 p mol••L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
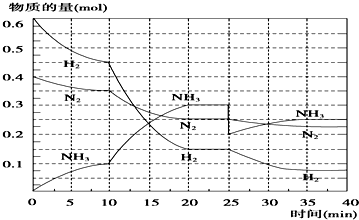
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 催化剂对反应的影响 | 平衡体系增加N2对反应的影响 |
| 图示 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com