
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{催化剂/△}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
分析 对比“乙烯氧化法”、“乙炔水化法”两种方法,从化学反应速率、日产量、消耗的催化剂的性质以及能源的消耗角度来回答.
解答 解:(1)对比“乙烯氧化法”、“乙炔水化法”两种方法,从产率和产量角度可以看出:虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多,
故答案为:虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
(2)对比“乙烯氧化法”、“乙炔水化法”两种方法,从环境保护和能耗角度可以知道两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,汞盐的毒性大,并且乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,但是乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得等,
故答案为:两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得.
点评 本题考查实验方案的设计和实验评价方面的题目,要求学生具有分析和解决问题的能力,综合性较强,难度大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
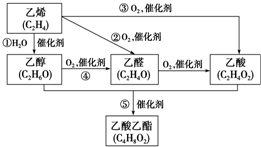 如图是由乙烯合成乙酸乙酯的几种可能的合成路线:
如图是由乙烯合成乙酸乙酯的几种可能的合成路线: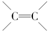 ,乙醇中含氧官能团的名称是羟基;
,乙醇中含氧官能团的名称是羟基;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
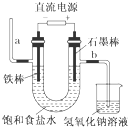
| A. | 装置中,a管能产生氢气 | |
| B. | 在石墨棒电极区域有NaOH产物 | |
| C. | b管导出的是氯气 | |
| D. | 以食盐水为基础原料制取氯气等产品的工业称为“氯碱工业” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
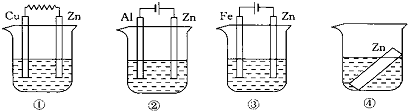
| A. | ①②③④ | B. | ②①③④ | C. | ③①④② | D. | ②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量NH4Cl固体,抑制水的电离 | |
| C. | 向水中加入少量NaOH固体,促进水的电离 | |
| D. | 向水中加入少量NaHSO4固体,抑制水的电离,c(H+)增大,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| B. | 溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| C. | 溶液①、③等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) | |
| D. | 溶液①、③等体积混合,混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关于其结构的叙述中,正确的是( )
,下列关于其结构的叙述中,正确的是( )| A. | 甲烷分子是正方形结构 | B. | 甲烷分子是正四面体结构 | ||
| C. | 甲烷分子是极性分子 | D. | 甲烷分子的四个键不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6 L H2,该乙醇分子中共价键总数为4 NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com