
分析 (1)根据Cu2S溶于过量的一定浓度的硝酸时,生成Cu(NO3)2与CuSO4的混合溶液、NO气体和另一产物结合元素守恒来书写;
(2)根据反应方程式结合硫酸根离子的量和转移电子之间的关系来计算;
(3)元素化合价升高,发生氧化反应,得到产物为氧化产物,据此结合元素化合价变化判断物质的性质.
解答 解:(1)根据Cu2S溶于过量的一定浓度的硝酸时,生成Cu(NO3)2与CuSO4的混合溶液、NO气体和另一产物结合元素守恒,得到另一种产物是水,即3Cu2S+16HNO3=3Cu(NO3)2+3CuSO4+10NO↑+8H2O,故答案为:3Cu2S+16HNO3=3Cu(NO3)2+3CuSO4+10NO↑+8H2O;
(2)根据反应:3Cu2S+16HNO3=3Cu(NO3)2+3CuSO4+10NO↑+8H2O,生成3mol硫酸根离子转移电子是30mol,所以当有0.7mol的SO42-生成时,该反应中转移的电子是7mol,即转移电子数是4.214×1024,故答案为:4.214×1024;
(3)Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,在这个反应中,Cu元素化合价由+1价升高为+2,而S元素化合价由-2价升高为CuSO4中的+6价,部分N元素化合价降低,故Cu(NO3)2、CuSO4是氧化产物,硝酸中氮元素化合价部分降低,部分转化为盐,体现氧化性和酸性.
故答案为:Cu(NO3)2、CuSO4;氧化性、酸性.
点评 本题考查氧化还原反应基本概念以及电子转移的计算,比较基础,注意根据化合价理解判断是关键.


科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂会改变反应的焓变 | |
| B. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 | |
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |
| D. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②证明Fe2+既有氧化性又有还原性 | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1.01×105Pa时,测得该液体的沸点是100℃ | |
| B. | T℃时,测得该液体的c(OH-)=$\sqrt{Kw}$mol/L | |
| C. | 电解该液体时,得到H2和O2体积比为2﹕1(相同条件) | |
| D. | 该液体能与乙醇以任意比互溶,且能与钠剧烈反应放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
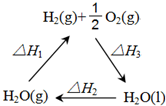 盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.某化学过程如图所示,△H1、△H2、△H3三者之间的关系式为△H1+△H2+△H3=0.
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.某化学过程如图所示,△H1、△H2、△H3三者之间的关系式为△H1+△H2+△H3=0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
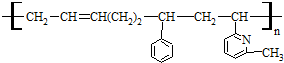
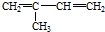
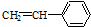
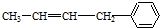
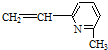
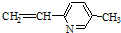
| A. | ②③⑥ | B. | ①②⑥ | C. | ②③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 半径:r(X2-)>r(Y+) | B. | 沸点:H2Z>H2X | C. | 稳定性:H2Z>HW | D. | 熔点:Y2X>Y2Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | 实验结论或目的 | 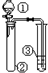 | |
| A | 浓盐酸 | KMnO4 | 石蕊试液 | 氯气的水溶液有酸性、漂白性 | |
| B | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| C | 硝酸 | Na2CO3溶液 | Na2SiO3溶液 | 比较硝酸、碳酸、硅酸酸性强弱 | |
| D | 溴水 | FeBr3、苯 | AgNO3溶液 | 苯和溴水能发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com