

���� I����1��a��ʱδ����ѧ��Ӧ��ƽ�⣬��ʱ��Ӧ������Ӧ��������ţ����v����v������ӦΪCO2��g��+3H2��g��?CH3OH��g��+H2O��g������ƽ�ⳣ��Ϊ$K=\frac{c��{H}_{2}O��c��C{H}_{3}OH��}{{c}^{3}��{H}_{2}��c��C{O}_{2}��}$������ƽ��Ũ�ȼ��㼴�ɣ�
��2�����ı�ijһʵ�������ٽ�������ʵ����H2�����ʵ�����ʱ��仯�Ĺ�ϵ�����ݷ�Ӧ���ʱ��H��0����Ӧ�����������ٵķ�����У���ϳ��õ�Ӱ�컯ѧƽ��ķ����������ı�ѹǿ���ı��¶ȣ��������ʵ����ȵȣ���������ٳ���3molCO2��4mol H2�������˷�Ӧ��Ũ�ȣ�ʹ��ѧƽ��������Ӧ�����ƶ���
II��KI��Һ�������ṩ�����Ի����£������������ɵ��ʵ⣬�ⵥ���������۱�����ͨ�����ô����ʼ���⣬�Ӷ��жϷ�Ӧ���ʵĿ�����
III����1�������У����Դ����������һ���������������Ϸ����ķ�ӦΪ����ʧȥ���ӱ���������ԭ��Խǿ�Ľ���������ʧȥ���ӱ����������ս������˳�������
��2��B�缫Ϊ���������������ķ�Ӧ������ʧȥ���ӱ���������ͼ2װ�ö�Ǧ���س�磬�������������ķ�Ӧ��PbSO4ʧȥ���ӣ�����PbO2���ڴ�д���缫��Ӧʽ��B�缫�����ɺ�����PbO2���ŵ�ʱ��PbO2��Ҫ���PbSO4����һ������Pb�õ����ӱ���ԭ����ԭ��ص�������
��3����25�桢101kPaʱ����CH4��������ֱ��ȼ������1molˮ��������401kJ����l gˮ����ת����Һ̬ˮ����2.445kJ���ݴ˿���д�������Ȼ�ѧ����ʽ�����ݸ�˹�������ܷ�Ӧ����ʽ��������Һ̬ˮʱ��Ӧ���ʱ䣮
��� �⣺I����1������ͼ���֪����a��ʱ����Ӧû�дﵽ��ѧƽ�⣬��ʱ��Ӧ��������Ӧ��������ţ�����v����v���������ķ�ӦΪ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g�����䷴Ӧ��ƽ�ⳣ��Ϊ$K=\frac{c��{H}_{2}O��c��C{H}_{3}OH��}{{c}^{3}��{H}_{2}��c��C{O}_{2}��}$��ƽ��ʱ������ͼ��ͷ�Ӧ�ķ���ʽ��֪��$c��{H}_{2}��=\frac{2}{2}=1mol/L$��$c��C{O}_{2}��=\frac{6-6��\frac{1}{3}}{2}=2mol/L$��$c��C{H}_{3}OH��=\frac{6��\frac{1}{3}}{2}=1mol/L$��$c��{H}_{2}O��=\frac{6��\frac{1}{3}}{2}=1mol/L$���ֱ����ƽ�ⳣ�������$K=\frac{1mol��1mol}{��1mol/L��^{3}��2mol/L}=\frac{1}{2}{L}^{2}/mo{l}^{2}$��
�ʴ�Ϊ�����ڣ�$\frac{1}{2}{L}^{2}/mo{l}^{2}$��
��2������ͼ����֪��ӦCO2��g��+3H2��g��?CH3OH��g��+H2O��g�������ʱ��H��0����Ӧ�����������ٵķ�����У�����ϵ���ҶȽ��ͣ����ر��S��0���۲�����1���ﵽƽ���ʱ�����̣���ƽ��ʱ�����ҽ��еij̶�û�иı�����֮ǰ�Ĵɿ��Ǹı������Ϊ�����¶ȣ���������ٳ���3molCO2��4mol H2�������˷�Ӧ��Ũ�ȣ���ѧƽ��������Ӧ�����ƶ������ɸ����H2O��g����������������䣬��ȻH2O��g���������������
�ʴ�Ϊ�������¶ȣ�����
II��KI��Һ�������ṩ�����Ի����£������������ɵ��ʵ⣬�ⵥ���������۱�����ͨ�����ô����ʼ���⣬�Ӷ��жϷ�Ӧ���ʵĿ���������Ӧ�ȼ��������Һ�������0.1mol/LH2SO4��Һ����Ӧ�����ӷ���ʽΪ��4H++4I-+O2=2I2+2H2O��
�ʴ�Ϊ��������Һ��0.1mol/LH2SO4��Һ��4H++4I-+O2=2I2+2H2O��
III����1�������У����Դ����������һ���������������Ϸ����ķ�ӦΪ����ʧȥ���ӱ���������ԭ��Խǿ�Ľ���������ʧȥ���ӱ���������֪�����ԣ�Fe2+��Ni2+��Cu2+����������Ʒ�к�Fe��Zn��Ag��Cu�����ֽ������ʣ��������ӵ�������Խǿ��������Ļ�ԭ��Խ������Ͻ������˳��������ȳ�����ӦΪAg��Cu���ʴ�Ϊ��Ag��Cu��
��2�������У����Դ����������һ������������B��Ϊ���������������ķ�Ӧ������ʧȥ���ӱ���������ͼ2װ�ö�Ǧ���س�磬�������������ķ�Ӧ��PbSO4ʧȥ���ӣ�����PbO2���缫��Ӧ����ʽΪ��PbSO4+2H2O-2e-=PbO2+4H++SO42-��B�缫�����ɺ�����PbO2���ŵ�ʱ��PbO2��Ҫ���PbSO4����һ������Pb�õ����ӱ���ԭ����ԭ��ص����������B�缫Ҳ��Ǧ����ԭ��ص�������
�ʴ�Ϊ��PbSO4+2H2O-2e-=PbO2+4H++SO42-��B��
��3�����ü���ȼ�ϵ��Ϊ��Դ����25�桢101kPaʱ����CH4��������ֱ��ȼ������1molˮ��������401kJ���˷�Ӧ���Ȼ�ѧ����ʽΪ����CH4��g��+O2��g��=CO2��g��+2H2O��g����H1=-802kJ/mol��l gˮ����ת����Һ̬ˮ����2.445kJ����$\frac{1}{18}mol$ˮ����ת��Ϊˮ����2.445kJ���˷�Ӧ���Ȼ�ѧ����ʽΪ����H2O��g��=H2O��l����H2=-44.01kJ/mol����ʾCH4ȼ���ȵķ���ʽΪCH4��g��+O2��g��=CO2��g��+2H2O��l�����˷�Ӧ���ɢ�+�ڡ�2�ɵã����ɸ�˹���ɣ��˷�Ӧ���ʱ�Ϊ��H=��H1+2��H2=-802-2��44.01=890.02kJ/mol����˱�ʾCH4ȼ���ȵ��Ȼ�ѧ����ʽΪCH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.02kJ/mol��
�ʴ�Ϊ��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.02kJ/mol��
���� ���⿼�黯ѧƽ����ƶ���ƽ�ⳣ���ļ��㣬�ⵥ�ʵļ��飬������ԭ��Ӧ�����ԭ����ԭ���ԭ���Լ��Ȼ�ѧ����ʽ����д����ע�⣬ʵ��ƽ�ⳣ�������λ���㣮���⿼��֪ʶ���ۺϣ���Ŀ�ѶȲ����ǻ����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ͼ��ʾװ�ã�������G����ƫת��a����֣�ͬʱb����ϸ��cΪ�������Һ����a��b��cӦ�����и����еģ�������
��ͼ��ʾװ�ã�������G����ƫת��a����֣�ͬʱb����ϸ��cΪ�������Һ����a��b��cӦ�����и����еģ�������| A�� | a��Ag��b��Fe��cΪAgNO3��Һ | B�� | a��Fe��b��Ag��cΪAgNO3��Һ | ||
| C�� | a��Zn��b��Cu��cΪϡH2SO4 | D�� | a��Cu��b��Zn��cΪϡH2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AlCl3��Һ�Ͱ�ˮ | B�� | AlCl3��Һ��CO2 | ||
| C�� | NaAlO2��Һ������ | D�� | NaAlO2��Һ��NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2��Si��CsCl��NaCl��H2O��H2Se��H2S | B�� | Si��SiO2��CsCl��NaCl��H2O��H2S��H2Se | ||
| C�� | SiO2��Si��NaCl��CsCl��H2O��H2Se��H2S | D�� | Si��SiO2��CsCl��NaCl��H2Se��H2S��H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϡƷ����Һ | B�� | �μӹ���������Һ��BaCl2��Һ | ||
| C�� | Ba��OH��2��Һ | D�� | ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Na+����c��HRO3-����c��H+����c��RO32-����c��OH-�� | B�� | c��Na+��+c��H+��=c��HRO3-��+c��RO32-��+c��OH-�� | ||
| C�� | c��Na+��=c��HRO3-��+��H2RO3��+2c��RO32-�� | D�� | ���϶�����ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �϶���KNO3�����ܻ�����Na2CO3 | B�� | �϶���Na2CO3���϶�û��KNO3 | ||
| C�� | �϶�û��Ba��NO3��2��������KNO3 | D�� | �϶�û��Na2CO3��Ba��NO3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
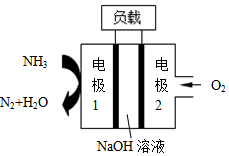 ���ASES��˾��Ƶ�����������DZͧ��Һ��-Һ��ȼ�ϵ��ʾ��ͼ��ͼ�������й�˵����ȷ���ǣ�������
���ASES��˾��Ƶ�����������DZͧ��Һ��-Һ��ȼ�ϵ��ʾ��ͼ��ͼ�������й�˵����ȷ���ǣ�������| A�� | ��ع���ʱ��Na+��缫1�ƶ� | |
| B�� | ��ع���ʱ�缫2������Һ��pH��С | |
| C�� | ����ܷ�ӦΪ��4NH3+3O2=2N2+6H2O | |
| D�� | �缫1�����ĵ缫��ӦΪ��2NH3-6e-=N2+6H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧ�� | H-H | H-Cl | H-Br | H-I |
| ����KJ•mol-1 | 436.0 | 431.8 | 366 | 298.7 |
| A�� | ���� | B�� | �Ȼ��� | C�� | �廯�� | D�� | �⻯�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com