
| A. | 2 | B. | 1 | C. | 3 | D. | 4 |
分析 根据恒温恒容条件下,对于反应前后气体分子数改变的反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”)与原平衡相等,则两平衡等效,又因为达平衡后压强不变,所以两个平衡要成完全等效关系,据此计算.
解答 解:根据恒温恒容条件下,对于反应前后气体分子数改变的反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”)与原平衡相等,则两平衡等效,又因为达平衡后压强不变,所以两个平衡是同一平衡状态,所以用极端转化后相同物质的量应相等,即0.6molC换算成A、B,A、B物质的量分别为1.2mol+$\frac{3}{x}$×0.6mol=3mol;0.4mol+$\frac{1}{x}$×0.6mol=1mol,解得x=1,而两边计量数相等,即x=4是等效平衡,平衡时只是体积分数仍为φ,但平衡时各物质的量不等,所以平衡时压强不等,综上所述x=1,故选B.
点评 本题考查的是等效平衡及化学平衡的有关计算,采用极限反应法求出A、B的物质的量,解题的关键是要抓住恒温恒容下压强也不变的等效平衡判断.


科目:高中化学 来源: 题型:选择题
| A. | 溴苯(溴):加入四氯化碳,振荡、静置、分液 | |
| B. | 乙醇(水):加入生石灰,蒸馏 | |
| C. | 乙酸乙酯(乙酸):加入氢氧化钠溶液,静置、分液 | |
| D. | 乙烯(乙烷):通过酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
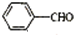 +NaOH→
+NaOH→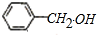 +
+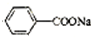 ,据此反应,以下说法正确的是( )
,据此反应,以下说法正确的是( )| A. | 该反应为氧化还原反应 | B. | 苯甲醛只还原苯甲醇 | ||
| C. | 苯甲醛只氧化为苯甲酸 | D. | 苯甲醛既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16mol | B. | 18mol | C. | 20mol | D. | 24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾具有杀菌消毒作用,可用于净水 | |
| B. | 烧碱不是碱、石炭酸不是酸、双氧水不是水 | |
| C. | 电解质在水溶液中的反应都是离子反应 | |
| D. | 我国首创的新型抗疟疾药青蒿素(C15H22O5)属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电了式: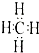 | B. | 乙炔的结构简式:CHCH | ||
| C. | 硫离子的结构示意图: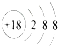 | D. | 中子数为10的原子:${\;}_{8}^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
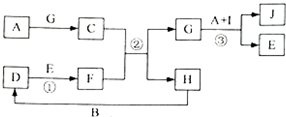
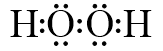 .
.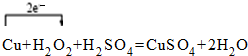 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) | B. | c(Na+)+c(H+)=c(OH-)+c(SO32-)+c(HSO3-) | ||
| C. | c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3) | D. | c(Na+)>c(SO32-)>c(OH-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
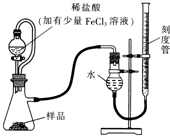 过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com