
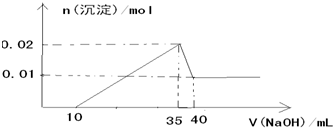
| 6.99g |
| 233g/mol |
| 0.01mol |
| 0.005L |
| 0.01mol |
| 0.005L |


科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 3 |
| 2 |
| N | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.
铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.- 4 |
- 4 |
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | ||
| 验证不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
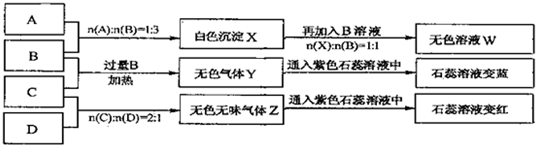
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com