
分析 (1)反应2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中,氧化剂是NaClO3,而还原剂是盐酸,其中盐酸只有一半参加氧化还原反应,两种方法相比较,方法一中生成的气体中含有氯气;
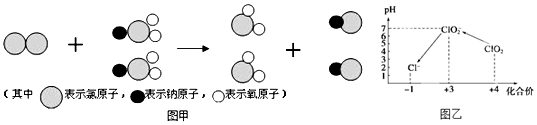
(2)由反应的微观过程图,可知,反应物和生成物,故可书写化学方程式;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子;
(4)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-;
③根据关系S2O32-~I-~ClO2先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)反应2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中,氧化剂是NaClO3,而还原剂是盐酸,其中盐酸只有一半参加氧化还原反应,所以氧化剂与还原剂的物质的量之比为1:1,因方法一制得的ClO2中含有Cl2,Cl2可能生成有机氯代物,则用方法二制备的ClO2更适合用于饮用水的消毒;
故答案为:1:1;方法二制备的ClO2中不含Cl2;
(2)由反应的微观过程图,可知此反应的反应物为Cl2、NaClO2;生成物为ClO2、NaCl,故可书写化学方程式Cl2+2NaClO2═2NaCl+2ClO2,故答案为:Cl2+2NaClO2═2NaCl+2ClO2;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-;
(4)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,
故答案为:2ClO2+2I-=2ClO2-+I2;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,
故答案为:蓝色消失,半分钟内不变色;
③S2O32-~I-~ClO2
1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1
故答案为:0.675.
点评 本题主要考查了氧化还原反应、离子方程式式的书写以及化学计算,题目难度中等,注意(4)③利用关系式进行求解.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O | |
| B. | 碳酸钡中加入稀硫酸:BaCO3+2H+═Ba2++CO2↑+H2O | |
| C. | 在澄清石灰水中通入过量二氧化碳 OH-+CO2═HCO3- | |
| D. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3的电离方程式:CaCO3═Ca2+CO32- | |
| B. | NaHS水解:HS-+H2O═H3O++S2- | |
| C. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 用少量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗1mol的H2O同时生成1mol的H2 | |
| B. | 两个H-O键断裂的同时有四个C-O键断裂 | |
| C. | 反应容器内的密度不再发生变化 | |
| D. | 混合气体的相对分子质量不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
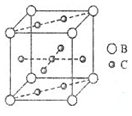 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q .
.| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚中加入Na2CO3溶液中:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 0.3molFeI2与0.4molCl2在溶液中反应:6Fe2++10I-+8Cl2═6Fe3++16Cl-+5I2 | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com