
| A、能电离出H+的物质不一定是酸 |
| B、蔗糖、碳酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、根据分散系中分散质粒子直径大小将分散系分为溶液、胶体和浊液 |
| D、焰色反应是化学变化 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、向Na2CO3溶液加入CaCl2溶液 |
| B、向CuSO4溶液中加入NaOH溶液 |
| C、向FeCl2溶液中加入过量NaOH溶液 |
| D、向Al2(SO4)3溶液中加入过量NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入催化剂,X的产率增大 |
| B、升高温度,Y的转化率增大 |
| C、当容器活塞可活动时,充入稀有气体,平衡不移动 |
| D、充入Z气体时,Z的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、s电子绕核旋转,其轨道为一圆圈,而p电子是走∞字形 |
| B、s轨道都是球形轨道 |
| C、轨道不同,电子云的取向不一样 |
| D、电子云图是形象地描述电子在空间单位体积内出现概率大小的图形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2(g)+H2(g)?CO(g)+H2O(g) |
| B、C(s)+CO2(g)?2CO(g) |
| C、2HI(g)?H2(g)+I2(g) |
| D、FeO(s)+CO(g)?Fe(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )| A、元素Y与元素Z的最高正化合价之和的数值等于9 |
| B、离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| C、原子半径的大小顺序为:rZ>rW>rQ>rX>rY |
| D、元素W的氢化物稳定性和还原性均比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
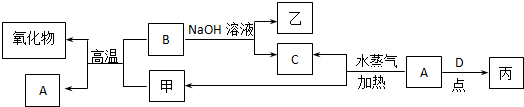
查看答案和解析>>
科目:高中化学 来源: 题型:
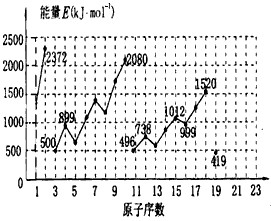
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com