
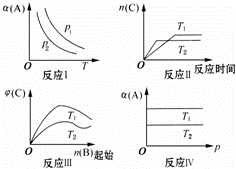
某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)⇌cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
分析图象,回答下列问题:
(1)在图象反应Ⅰ中,若p1>p2,则此正反应为 (填“吸热”或“放热”)反应,也是一个气体分子数 (填“减少”或“增大”)的反应,由此判断,此反应自发进行,必须满足的条件是 .
(2)在图象反应Ⅱ中,T1 < T2(填“>”、“<”或“=”),该正反应为 (填“吸热”或“放热”)反应.
(3)在图象反应Ⅲ中,若T2>T1,则此正反应为 (填“吸热”或“放热”)反应.
(4)在图象反应Ⅳ中,若T1>T2,则该反应能否自发进行?
| 化学平衡建立的过程;化学平衡的调控作用.. | |
| 专题: | 图示题. |
| 分析: | (1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,△H<0;恒定温度时压强越大,α(A)越大,说明此a+b>c,即为熵减反应,△S<0;放热、熵减反应只能在低温下自发进行; (2)“先拐先平数值大”T2温度下反应先达到平衡状态,说明T2>T1,温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应; (3)图象出现的原因为:同一温度下,增加B的物质的量,平衡向右移动,φ(C)增大,但当B的物质的量达到一定程度后,对C的稀释作用会大于平衡右移对C的影响,若T2>T1,温度越高φ(C)越小,即升高温度平衡向左移动; (4)恒温下压强变化对α(A)没有影响,说明a+b=c,△S≈0,若T1>T2,恒压下温度越高α(A)越大,说明升高温度平衡向右移动,正反应为吸热反应,△H>0,则△H﹣T△S>0,反应不能自发进行. |
| 解答: | 解:(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,则正反应为放热反应,△H<0;由p1>p2知恒定温度时压强越大,α(A)越大,即增大压强平衡向右移动,说明此反应为气体分子数减少的反应(a+b>c),即为熵减反应,△S<0.放热、熵减反应只能在低温下自发进行, 故答案为:放热;减少;低温; (2)反应Ⅱ中T2温度下反应先达到平衡状态,说明T2>T1;温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0, 故答案为:<;放热; (3)反应Ⅲ中同一温度下,增加B的物质的量,平衡向右移动,φ(C)增大,但当B的物质的量达到一定程度后,对C的稀释作用会大于平衡右移对C的影响,φ(C)又减小,出现如图所示的曲线.若T2>T1,温度越高φ(C)越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0, 故答案为:放热; (4)反应Ⅳ中在恒温下压强变化对α(A)没有影响,说明压强变化不能影响平衡,此反应为气体分子数不变的反应(a+b=c),反应过程中熵变很小,△S≈0,若T1>T2,恒压下温度越高α(A)越大,说明升高温度平衡向右移动,正反应为吸热反应,△H>0,则△H﹣T△S>0,反应不能自发进行, 答:不能自发进行. |
| 点评: | 本题涉及图象的分析及化学平衡的移动和反应进行的方向等知识点,整合性较强,通过图象中数据的变化判断化学平衡移动的方向是解题的关键. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化学概念在逻辑上存在如下关系:

对下列概念的说法正确的是( )
A.化合物与纯净物属于重叠关系
B.化合物与碱性氧化物属于交叉关系
C.分解反应与复分解反应属于并列关系
D.硫酸与硝酸只有交叉关系
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO、SiO、SO、CO、SO中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是 ( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、AlO和SiO一定存在于溶液X中
D.CO和SO一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列相关离子方程式书写正确的是( )
|
| A. | NaClO溶液与FeCl2溶液混合:6Fe2++3ClO﹣+3H2O═2Fe(OH)3↓+3Cl﹣+4Fe3+ |
|
| B. | 用食醋检验牙膏中的碳酸钙:CaCO3+2H+═Ca2++CO2↑+H2O |
|
| C. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O |
|
| D. | 电解MgCl2水溶液的离子方程式:2Cl﹣+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )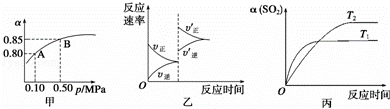
|
| A. | 由图甲知,A点SO2的平衡浓度为0.4 mol/L |
|
| B. | 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 |
|
| C. | 达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
|
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验报告记录的实验现象正确的是( )
| 实验 |
| ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对离子方程式的评价不合理的是
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通入少量的SO2:ClO-+H2O+SO2===Cl-+SO | 错误,碱性介质中不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸:2MnO | 正确 |
| C | NH4Al(SO4)2溶液中滴入几滴NaOH溶液:NH | 错误,OH-首先和Al3+反应生成Al(OH)3沉淀 |
| D | 用惰性电极电解MgCl2溶液:2Mg2++2H2O | 正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com