
| A. | 决定化学反应速率的主要因素是光照、超声波、压强和催化剂等 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| C. | 可逆反应进行到一定程度时,正、逆反应速率相等.各物质浓度也相等 | |
| D. | 生产过程中,化学反应限度是决定原料利用率和产品产率的重要因素之一 |
分析 A.影响化学反应速率的因素有内因和外因,内因为物质的本身性质,为主要因素;
B.浓硫酸与铁在常温下发生钝化现象,阻止了反应的继续进行,且浓硫酸与铁反应不会生成氢气;
C.当正逆反应速率相等时,反应达到平衡状态,各物质的浓度不变,但不一定相等;
D.一定条件下化学反应限度决定原料利用率和产品产率.
解答 解:A.决定化学反应速率的主要因素是物质的本身性质,而光照、超声波、压强和催化剂等为次要因素,故A错误;
B.常温下,铁与浓硫酸发生钝化现象,且浓硫酸与铁反应不会生成氢气,故B错误;
C.可逆反应到一定程度时,会出现正、逆反应速率相等,各物质浓度不变,但各组分的浓度不一定相等,故C错误;
D.化学反应限度反映了可逆反应进行的程度,所以化学反应限度是决定原料利用率和产品产率的重要因素之一,故D正确;
故选D.
点评 本题考查反应速率和化学平衡移动问题,题目难度中等,注意把握影响反应速率的因素,学习中注意积累,易错点是A,注意影响化学反应速率的因素有内因和外因,内因为物质的本身性质,为主要因素.


科目:高中化学 来源: 题型:解答题

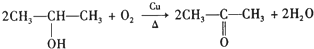
 )、有机物W是碳酸二甲酯的同分异构体,W具有如下特征:
)、有机物W是碳酸二甲酯的同分异构体,W具有如下特征:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:3:2 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
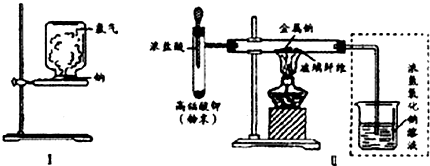
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
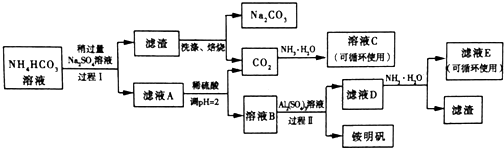
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不经切割,直接用大块的钠做实验 | B. | 用手小心抓住钠块投入烧杯中 | ||
| C. | 在烧杯口盖上玻片后再观察现象 | D. | 将剩余的钠块放入废液缸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com