
| A. | 酸性氧化物:CO2、SO2、SiO2、NO | B. | 盐:Na2CO3、KHCO3、Cu2(OH)2CO3 | ||
| C. | 非电解质:酒精、蔗糖、氨气、次氯酸 | D. | 混合物:液氯、盐酸、胆矾、氯水 |
分析 A、能和碱反应生成盐和水的化合物是酸性氧化物;
B、能电离出金属阳离子或铵根离子和酸根阴离子的化合物属于盐;
C、在水溶液和熔融状态下都不导电的化合物叫做非电解质;
D、含有不同分子的物质是混合物.
解答 解:A、CO2、SO2、SiO2是酸性氧化物,但是NO不和碱反应,不是酸性氧化物,故A错误;
B、Na2CO3、KHCO3、Cu2(OH)2CO3能电离出金属阳离子和酸根阴离子,属于盐,故B正确;
C、酒精、蔗糖、氨气在水溶液和熔融状态下都不导电,是非电解质,但是次氯酸是电解质,故C错误;
D、盐酸、氯水是含有不同分子的物质,是混合物,但是液氯、胆矾属于纯净物,故D错误.
故选B.
点评 本题涉及物质的分类知识,注意概念的掌握和应用是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-=CO2↑+H2O | |
| C. | 向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ | |
| D. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+,SO42-,Ca2+,Cl- | B. | ClO-,Ba2+,K+,NO3- | ||
| C. | HCO3-,Cl-,Na+,Ca2+ | D. | Fe2+,I-,Na+,K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
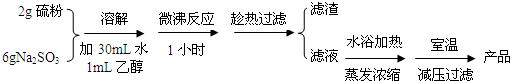
| 组号 | 反应温度(℃) | Na2S2O3 | H2O | H2SO4 | ||
| V/mL | c/mol•L-1 | V/mL | V/mL | c/mol•L-1 | ||
| ① | 10 | 10 | 0.1 | 0 | 10 | 0.1 |
| ② | 10 | 5 | 0.1 | 5 | 10 | 0.1 |
| ③ | 30 | 10 | 0.1 | 0 | 10 | 0.1 |
| ④ | 30 | 5 | 0.1 | 5 | 10 | 0.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,Ca2+的配位数与F-的配位数之比为1:2 | |
| C. | 氢原子的电子云图如图3所示,表示一段时间内氢原子核外1个电子在空间出现的概率 | |
| D. | 金属Cu中铜原子堆积模型如图4,该金属晶体为面心立方最密堆积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 相同温度下,将足量氯化银固体分别加入:①蒸馏水、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1盐酸、④0.1 mol•L-1硝酸银溶液中,充分溶解后Ag+浓度:①>③=④>② | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7 | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com