
分析 (1)硝酸银与氯化钾溶液反应生成硝酸钾和氯化银沉淀;
(2)硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水;
(3)氢氧化钠溶液与盐酸反应生成氯化钠和水;
(4)锌与硫酸铜溶液反应生成硫酸锌和铜.
解答 解:(1)AgNO3溶液与KCl溶液混合,二者反应生成氯化银沉淀和硝酸钾,反应的离子方程式为:Ag++Cl-=AgCl↓,
故答案为:Ag++Cl-=AgCl↓
(2)硫酸和氢氧化钡溶液混合,二者反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(3)NaOH与盐酸发生中和反应生成NaCl和水,反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
(4)锌投入硫酸铜溶液中,二者发生置换反应,反应的离子方程式为:Zn+Cu2+=Zn2++Cu,
故答案为:Zn+Cu2+=Zn2++Cu.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:解答题
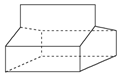 按要求回答问题:
按要求回答问题: ;
;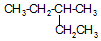 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
. ,如果要合成
,如果要合成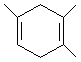 ,所用的原料可以是
,所用的原料可以是 查看答案和解析>>
科目:高中化学 来源: 题型:实验题
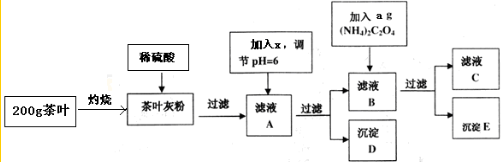
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
| 编号 | 终点时消耗KMnO4溶液体积(mL) |
| 1 | 19.98 |
| 2 | 22.00 |
| 3 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 组成 | 体积比 |
| 1 | ||
| 2 | ||
| 3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬铝的密度约为钢材的三分之一,是适合于做飞行器的材料 | |
| B. | 硬铝的强度比铝大得多,铝材比钢材的某些性能要好 | |
| C. | 硬铝的熔点跟铝相比有一定的提高,常被用于炊具 | |
| D. | 硬铝的抗腐蚀性较强,常被用于制门窗框架 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
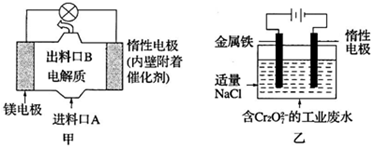
| A. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓ | |
| C. | 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生 | |
| D. | 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
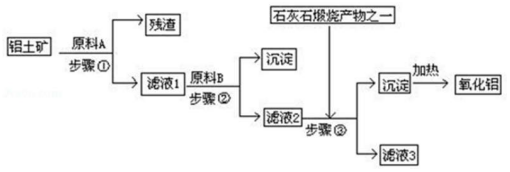
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ•mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA | |
| C. | lmol•L1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为NA | |
| D. | 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com