
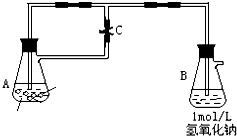
 图中为制取纯净且能较长时间存在的Fe(OH)2,药品为铁粉、稀H2SO4,NaOH溶液,当容器A中反应开始后,若分别进行下列操作,请回答有关问题:
图中为制取纯净且能较长时间存在的Fe(OH)2,药品为铁粉、稀H2SO4,NaOH溶液,当容器A中反应开始后,若分别进行下列操作,请回答有关问题:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数必为0.5NA | ||||
| B、常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3×6.02×1023 | ||||
| C、等体积0.2mol?L-1HCl溶液与0.05mol?L-1Ba(OH)2溶液混合后,溶液的pH=1 | ||||
D、溶液中由水电离出的c(H+)=1×10-12mol?L-1,S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、1molNH
| ||
| B、8 g甲烷中含有2NA个碳氢共价键 | ||
| C、1 mol Na2O2含2NA个阴离子 | ||
| D、标准状况下,22.4L H2O含有NA个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用NH4Cl和Ca(OH)2制备NH3 | B、工业上电解熔融状态的Al2O3制备Al | C、工业上利用合成氨实现人工固氮 | D、Na2O2用作呼吸面具的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、d=a+17b | ||
B、C1=
| ||
C、铝为
| ||
| D、与金属反应后剩余盐酸为(C1V1-2b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
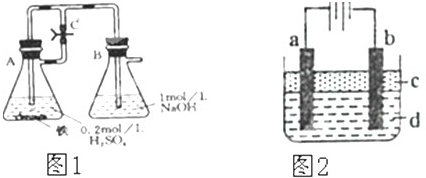
 用下面两种方法可以制得白色的Fe(OH)2沉淀.
用下面两种方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 | B、将过量CO2通入漂白粉溶液,所得溶液漂白性增强;将过量SO2通入漂白粉溶液,所得溶液漂白性也增强(不考虑SO2溶解) | C、Al(OH)3、Cu(OH)2受热易分解;Fe(OH)3受热也易分解 | D、37℃时,Fe3+、Cu2+能催化H2O2的分解;100℃时,MnO2、过氧化氢酶也能催化H2O2的分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5是指大气中直径≤2.5微米的颗粒物,只要戴普通口罩就对人体健康无影响 | B、垃圾是放错地方的资源,应分类回收利用 | C、高纯度的硅单质广泛用于制作光导纤维,光导纤维是新型高分子非金属结构材料 | D、地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com