
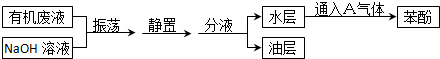
 .
. 分析 甲苯、二甲苯、苯酚三种物质中只有苯酚和NaOH反应生成溶于水的苯酚钠,经振荡、静置、分液后得到的水层为苯酚钠溶液,由于苯酚的酸性比碳酸弱,在溶液中通入二氧化碳气体可得到苯酚,以此解答该题.
解答 解:苯、二甲苯、苯酚三种物质中只有苯酚和NaOH反应生成溶于水的苯酚钠,经振荡、静置、分液后得到的水层为苯酚钠溶液,由于苯酚的酸性比碳酸弱,在溶液中通入二氧化碳气体可得到苯酚,
(1)由以上分析可知A为CO2,故答案为:CO2;
(2)由于苯、二甲苯、苯酚混溶,为使苯酚与NaOH充分反应,应充分振荡,可使苯酚与NaOH充分接触而反应,
故答案为:使苯酚与氢氧化钠充分反应;
(3)分液时常用分液漏斗分离互不相溶的两种液体混合物,
故答案为:分液漏斗;
(4)苯酚与浓溴水反应,是苯酚分子中羟基对苯环影响,邻对位氢原子活泼,易于发生取代反应,反应的化学方程式为: ,
,
故答案为: .
.
点评 本题综合考查物质的分离提纯,为高频考点和常见题型,侧重于学生的分析、实验能力的考查,题目难度中等,注意根据物质的性质设计实验方案,为解答该类题目的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.06 mol/(L•min) | B. | v(NH3)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.04 mol/(L•min) | D. | v(N2)=0.04 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
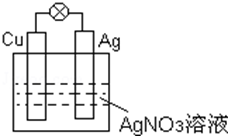 如图所示的原电池中:
如图所示的原电池中:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ①③⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和Y的总能量一定高于M和N的总能量 | |
| B. | X能量一定高于Y | |
| C. | 因该反应为放热反应,故不必加热就可发生 | |
| D. | Y能量一定高于N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com