


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| OH- |
| H+ |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |

查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制FeC13溶液时,要滴加少量的盐酸 |
| B、加热蒸干并灼烧Na2SO3溶液,得到Na2SO4固体 |
| C、明矾净水 |
| D、氨态氮肥(含NH4+)不能与草木灰混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2min末,A和B的浓度之比为5:3 |
| B、x=1 |
| C、2min末,B的浓度为1.5 mol?L-l |
| D、2min末,A的消耗浓度为0.5 mol?L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:
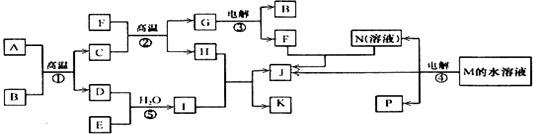
| B |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com