
NA表示阿伏加德罗常数,下列叙述正确的是( )
|
| A. | 0.1mol•L﹣1的Na2CO3溶液中含CO32﹣为0.1NA |
|
| B. | 3.2 g O2和O3的混合气中氧原子数为0.2NA |
|
| C. | 1mol H3O+含质子数为10 NA |
|
| D. | 标准状况下,22.4 L乙醇的分子数为NA |
| 阿伏加德罗常数.. | |
| 专题: | 阿伏加德罗常数和阿伏加德罗定律. |
| 分析: | A、溶液体积不明确; B、根据O2和O3均由氧原子构成来计算; C、1molH3O+含10mol质子; D、标况下,乙醇为液态. |
| 解答: | 解:A、溶液体积不明确,再者CO32﹣是弱酸根,在溶液中会水解,故无法计算CO32﹣的物质的量,故A错误; B、O2和O3均由氧原子构成,故3.2g混合气体中氧原子的物质的量n= C、1molH3O+含10mol质子,个数为10NA个,故C错误; D、标况下,乙醇为液态,故D错误. 故选B. |
| 点评: | 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大. |


科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是
| X | Y | ||
| Z | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
将盛有NH4HCO3粉末的小烧杯放入盛 有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A. NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物是重要的非金属材料。由石英砂制取高纯硅的主要化学反应有:
①粗硅的制取:SiO2+2C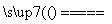 Si(粗)+2CO
Si(粗)+2CO
②粗硅中Si与Cl2反应:Si(s)+2Cl2(g)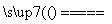 SiCl4(g) ΔH=-akJ/mol
SiCl4(g) ΔH=-akJ/mol
③粗硅的提纯反应:SiCl4(g)+2H2(g)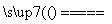 Si(s)+4HCl(g)'ΔH
Si(s)+4HCl(g)'ΔH
请回答下列问题:
(1)上述三个反应都属于________(填反应类型)。
(2)已知1mol Si固体中有2mol Si-Si键,1mol O2中有1mol O=O键,1mol SiO2固体中有4mol Si-O键。某些化学键数据如下:
| 化学键 | Si-O | Cl-Cl | H-H | H-Cl | Si-Si | O=O |
| 断键所需能量/(kJ·mol-1) | 460 | 243 | 436 | 431 | 176 | 498 |
根 据化学键数
据化学键数 据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
(3)可由反应②和另一个反应______________________________ (填化学方程式)通过盖斯定律计算获得反应③的反应热,若该反应每生成1mol化合物的反应热ΔH=-bkJ/mol,则反应③的反应热ΔH=________kJ/mol(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
|
| A. | 向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN﹣⇌Fe(SCN)3↓ |
|
| B. | 向NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O |
|
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓ |
|
| D. | 用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O=3I2+6OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )

|
| A. | 若甲是AlCl3溶液,则丁可能是NaOH溶液 |
|
| B. | 若甲是Fe,则丁可能是Cl2 |
|
| C. | 若丁是CO2,则甲可能为Mg |
|
| D. | 若丁是O2,则乙、丙的相对分子质量可能相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
水是生命之源,也是化学反应的主角.试回答下列问题:
P、Q、R是中学化学常见的三种有色物质(其组成元素均属于短周期元素),摩尔质量依次增大,它们均 能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出P、Q、R与水反应的化学方程式:
(1)P+H2O: ;
(2)Q+H2O: ;
(3)R+H2O: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.已知Ksp[Fe(OH)3]=4.0×10—38,则常温下Fe3++3H2O Fe(OH)3+3H+的平衡常数K=2.5×10—5
Fe(OH)3+3H+的平衡常数K=2.5×10—5
B.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L—1的NaOH标准溶液
C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D.催化剂通过降低化学反应的焓变加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
A.Na+、K+、Cl-、SO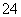 B.Cu2+、Fe2+、NO
B.Cu2+、Fe2+、NO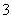 、SO
、SO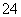
C.Na+、Ca2+、Cl-、ClO- D.K+、NH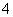 、Cl-、SO
、Cl-、SO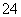
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com