
| 2.8g |
| 56g/mol |
| 0.03mol |
| 0.2L |


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
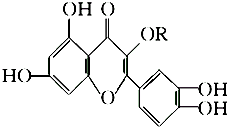 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、最多可以和含6 molBr2的溴水反应 |
| B、可用有机溶剂萃取 |
| C、分子中有三个苯环 |
| D、1 mol 维生素P可以和4 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
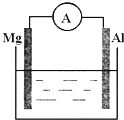 (1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为
(1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
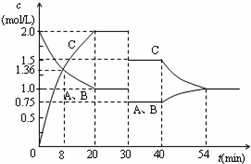 某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)?2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如右图所示.下列说法中正确的是( )
某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)?2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如右图所示.下列说法中正确的是( )| A、30min时降低温度,40min时升高温度 |
| B、40min~54min之间反应速率v(正)<v(逆) |
| C、设20min和30min时的平衡常数分别为K1和K2,则K1>K2 |
| D、0~8minA的平均反应速率为0.64mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com