
| A. | 该反应为置换反应 | B. | 每生成1mol O2转移4mol e- | ||
| C. | H2O2被还原 | D. | 反应后溶液pH值升高 |
分析 反应H2O2+Cl2=2HCl+O2中,O元素化合价由-1价升高到0价,被氧化,Cl元素化合价由0价降低到-1价,被还原,以此解答该题.
解答 解:A.反应特点为一种单质和一种化合物反应生成另一种单质和另一种化合物,为置换反应,故A正确;
B.由化合价变化可知,反应中Cl元素化合价由0价降低到-1价,则每生成1mol O2转移2mol e-,故B错误;
C.O元素化合价由-1价升高到0价,H2O2被氧化,故C错误;
D.反应生成HCl,溶液pH减小,故D错误.
故选A.
点评 本题考查氧化还原反应,侧重于基本概念的判断,根据元素化合价升降结合基本概念来分析解答,熟悉元素化合价是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氧化产物只有N2 | |
| B. | 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离 | |
| C. | 若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1 L含CN-1.02 mg/L的废水,至少需要4.0×10-5mol 氯气处理后才符合排放标准 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  可用于NaCl与NH4Cl混合物的分离 | |
| B. |  用于去除Fe(OH)3胶体中含有的可溶性物质 | |
| C. |  橡皮管起到平衡气压、使液体顺利流下的作用 | |
| D. |  若该仪器为酸式滴定管,则表示其内液体体积为5.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
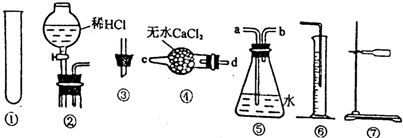
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用其它试剂便无法区别NaCl、Na2CO3、NaHSO4、AlCl3四种溶液 | |
| B. | 实验室常用带玻璃塞的试剂瓶保存NaOH溶液 | |
| C. | 用导线将电解池和电池连接,电子从电池的负极流向电解池的阳极 | |
| D. | 用以下反应制取硫酸铜:2Cu+O2═2CuO、CuO+H2SO4=CuSO4+H2O符合绿色化学的理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L HF气体分解成1L H2和1L F2吸收270KJ热量 | |
| B. | 1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270KJ | |
| C. | 在相同条件下1mol H2与1mol F2的能量总和大于2mol HF气体的能 | |
| D. | 1个氢分子与1个氟分子反应生成2个氟化氢分子放出279KJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3含有的原子数为4NA | |
| B. | 78 g过氧化钠中含有的离子数为4NA | |
| C. | 过氧化钠与CO2反应生成32g O2,则反应转移的电子数为2NA | |
| D. | 密闭容器中,标准状况下22.4L SO2和11.2LO2 在加热、有催化剂的条件下充分反应,容器中的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
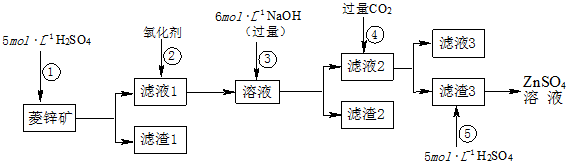
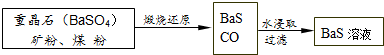
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com