
| A.原子晶体中只存在非极性共价键 |
| B.稀有气体形成的晶体属于分子晶体 |
| C.干冰升华时,分子内共价键会发生断裂 |
| D.分子晶体的熔点普遍都很高 |
科目:高中化学 来源:不详 题型:单选题
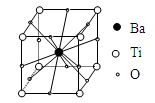
| A.BaTi8O12 | B.BaTi4O6 |
| C.BaTi2O4 | D.BaTiO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
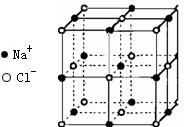
 (4)晶体中,Fe离子间最近距离为 cm
(4)晶体中,Fe离子间最近距离为 cm查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碘和氯化钾 | B.金刚石和重晶石 |
| C.二氧化硅和干冰 | D.软脂酸甘油酯和冰醋酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
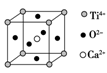
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
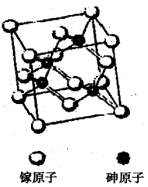
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
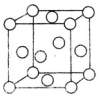 铜合金是人类使用最早的金属材料,铜在化合物中常见的化合价有+1、+2价,能形成多种铜的化合物。
铜合金是人类使用最早的金属材料,铜在化合物中常见的化合价有+1、+2价,能形成多种铜的化合物。| A.离子键 | B.金属键 | C.配位键 | D.共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com