
下列反应的离子方程式正确的是 ( )
A.铝片和氢氧化钠溶液反应:Al+2OH—=AlO2—+H2↑
B.Cl2通入冷水中:Cl2+H2O=Cl-+ClO-+2H+
C.铜与稀硝酸反应:3Cu+2NO3—+8H+=3Cu2++2NO↑+4H2O
D.小苏打溶液跟澄清的石灰水反应:HCO3—+OH-=CO32-+H2O
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.汽油是含有C5~C11的烷烃,可以通过石油的分馏得到汽油
B.含C18以上烷烃的重油经过催化裂化可以得到汽油
C.煤是由有机物和无机物组成的混合物
D.煤含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
绿矾(FeSO4·7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为(NH4)2SO4+FeSO4+6H2O===(NH4)2SO4·FeSO4·6H2O↓。其流程可表示为
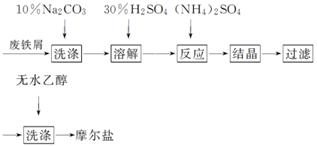
(1)洗涤中Na2CO3的主要作用是______________________________________。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到________时,停止加热。
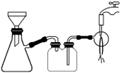
(3)过滤是用右图所示装置进行的,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是________________________________________________________________________。
(4)用无水乙醇洗涤的目的是____________________________________________
________________________________________________________________________。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准溶液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液10.00 mL。
①本实验的指示剂是________(填字母)。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
②产品中Fe2+的质量分数为______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是( )
A.氨气极易溶解于水的性质可以解释氨气的喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
D.氨水的热稳定性强可以解释实验室中用加热氨水的方法制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,既能跟强酸溶液反应,又能跟强碱溶液反应,并且生成物只是盐和水的是()
A.Al(OH)3 B.Al C.NaHCO3 D.Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于影响化学反应速率因素的解释不正确的是
A.若仅加入催化剂,改变反应途径→降低反应所需要的活化能→活化分子数增多→有效碰撞次数增多→化学反应速率增大
B.若仅增大反应物浓度,单位体积活化分子数增多→单位体积有效碰撞次数增多→化学反应速率增大
C.若仅升高温度,活化分子百分数增加且分子间的碰撞频率提高 →有效碰撞次数增多→化学反应速率增大
D.若仅加大体系压强,体积变小→活化分子百分数增加→单位体积的活化分子数目增加→有效碰撞次数增多→化学反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com