
分析 (1)原电池反应是自发进行的放热的氧化还原反应;
(2)根据电池反应式知,失电子化合价升高的金属单质作负极、不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液为原电池电解质溶液;
根据转移电子和Cu之间的关系式计算消耗Cu的质量.
解答 解:(1)原电池反应是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,所以不是氧化还原反应,不能设计成原电池,(B)中Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以(B)能设计成原电池,
故答案为:能;不能;
(2)①根据电池反应式知,失电子化合价升高的金属单质作负极、不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液为原电池电解质溶液,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极、FeCl3溶液作电解质溶液,
故答案为:Cu;FeCl3溶液;
②负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应,所以负极、正极反应式分别为Cu-2e-=Cu2+、2Fe3++2e-=2Fe2+,故答案为:
Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+;
③根据负极反应式Cu-2e-=Cu2+得消耗m(Cu)=$\frac{1mol}{2mol}×64g/mol$=32g,
故答案为:32.
点评 本题考查原电池设计,明确原电池原理及原电池反应特点是解本题关键,侧重考查学生知识运用能力,难点是判断正负极及电解质溶液,题目难度不大.


科目:高中化学 来源: 题型:选择题
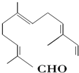 现有试剂:
现有试剂:| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
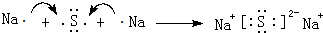 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.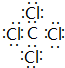 ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
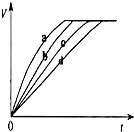 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | C(HCL)(mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-1-2 | B. | 1-2-4-3 | C. | 4-2-3-1 | D. | 4-3-2-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2 C6H5ONa+H2O+CO2→2 C6H5OH+Na2CO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| C. | C6H5OH+Na2CO3→C6H5ONa+NaHCO3 | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
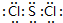 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
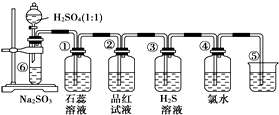 如图是实验室制备SO2并验证SO2某些性质的装置图.
如图是实验室制备SO2并验证SO2某些性质的装置图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com