
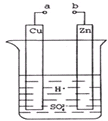
 原电池是化学对人类的一个重大贡献.
原电池是化学对人类的一个重大贡献.分析 (1)①a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应;
②a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极;
③负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气;
(2)根据锌与转移电子之间的关系式计算.
解答 解:(1)①a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子反应方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
②a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑;锌失电子发生氧化反应而作负极,
故答案为:正;氧化;
③铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑;锌失电子发生氧化反应而作负极,电极反应式为Zn-2e-=Zn2+,
故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)a和b用导线连接,该装置构成原电池,据电极反应式Zn-2e-=Zn2+可知,每转移2mol电子生成1mol锌,锌片减少的质量=$\frac{0.2mol}{2}$=6.5g,故答案为:6.5;
点评 本题考查原电池原理、据电极反应式的有关计算等知识点,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇醛糖是一种有机物,不易溶于水 | |
| B. | 乙醇醛糖能发生取代反应、加成反应、氧化反应以及还原反应 | |
| C. | 乙醇醛糖与甲酸乙酯互为同分异构体 | |
| D. | 1 mol 乙醇醛糖与足量的银氨溶液作用,可析出1 molAg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-50.405 kJ•mol-1 | |
| B. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=+2 217.82 kJ•mol-1 | |
| C. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=+50.405 kJ•mol-1 | |
| D. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 217.82 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物只能由金属元素和非金属元素组成 | |
| B. | 离子化合物只能存在离子键 | |
| C. | HCl能电离出氢离子和氯离子,所以HCl存在离子键 | |
| D. | 共价化合物中不可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期的所有金属离子中,Y的离子半径最小 |
| Z | Z与Y同周期,是所在周期中原子半径最小的元素 |
| T | T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
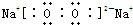 ,该化合物中所含的化学键有离子键、共价键(填化学键名称).
,该化合物中所含的化学键有离子键、共价键(填化学键名称).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量时,应将NaOH固体放在小烧杯或玻璃器皿中 | |
| B. | 将烧杯中未冷却的NaOH溶液直接注入未经干燥的容量瓶中 | |
| C. | 定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切 | |
| D. | 将称好的NaOH固体放入烧杯中,加入适量水溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com