
| A. | 配制一定物质的量浓度的硫酸溶液时,只需使用1次玻璃棒 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时即停止加热 | |
| C. | 液溴盛放在用水液封的棕色试剂瓶中 | |
| D. | 用四氯化碳萃取碘的饱和水溶液中的碘.分液时显紫红色液体在下层 |
分析 A.在烧杯中稀释、转移液体均需要玻璃棒;
B.蒸发皿中的溶液不能完全蒸干,当大量晶体析出时,要用余热来蒸干;
C.液溴易挥发;
D.四氯化碳的密度比水密度大.
解答 解:A.在烧杯中稀释、转移液体均需要玻璃棒,则配制一定物质的量浓度的硫酸溶液时.需使用2次玻璃棒,故A错误;
B.用蒸发方法使NaCl从溶液中析出时,蒸发皿中有大量晶体析出时,停止加热,要用余热来蒸干,故B正确;
C.液溴易挥发,一般采用水液封的办法以减少挥发,故C正确;
D.四氯化碳的密度比水密度大,碘的四氯化碳溶液位于下层,故D正确.
故选A.
点评 本题考查物质的分离和提纯的方法,属于综合知识的考查题目,要求学生具有分析和解决问题的能力,难度较大.


科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(OH-)+c(M+)=c(H+)+c(A-) | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液和NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO${\;}_{3}^{-}$)-c(CO${\;}_{3}^{2-}$) | |
| C. | 等浓度、等体枳的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水,②10mL0.2mol/LMgCl2,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
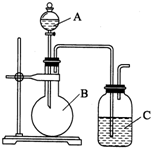 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁杵成针 | B. | 抱薪救火 | C. | 闭门造车 | D. | 刻舟求剑 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2+SO2+2H2O═H2SO4+2HBr | B. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | ||
| C. | 4NH3+5O2═4NO+6H2O | D. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
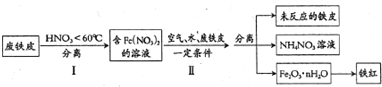
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
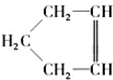 ,可简写为
,可简写为 ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为 .
. .(任选一种)
.(任选一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
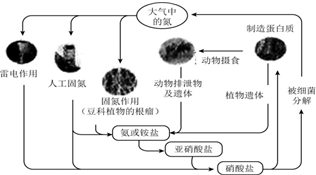
| A. | 上述氮循环中氮元素均被氧化 | |
| B. | 打雷闪电时涉及的一个反应为N2+2O2═2NO2 | |
| C. | 含氮无机物和含氮有机物可相互转化 | |
| D. | 自然界氮循环中氮元素的质量增加了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com