
分析 2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,得失电子最小公倍数是10,高锰酸钾是氧化剂,部分浓盐酸是还原剂,根据化合价的变化分析电子转移.
解答 解:(1)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价升高,被氧化,当有2molKMnO4参加反应,转移电子10mol,则电子转移的方向和数目可表示为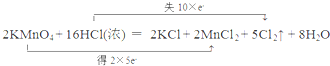 ,反应中部分HCl做还原剂,部分显酸性;
,反应中部分HCl做还原剂,部分显酸性;
故答案为: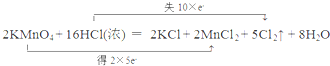 ;酸;还原.
;酸;还原.
(2)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 反应中Mn元素化合价由+7价变为+2价,1molKMnO4反应转移5mol电子生成2.5mol氯气,则当有2.5mol Cl2生成时,转移5mol电子;
故答案为:5.
点评 本题考查了氧化还原反应,根据元素化合价变化确定氧化剂和还原剂,再结合基本概念来分析解答,注意浓盐酸的作用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.| 实 验 | 实验现象 | 结 论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞溶液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 产生白色沉淀 | 固体产物是Na2CO3,而不是NaOH |
| 实验三:取少量反应后的固体产物溶于水,加入足量稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
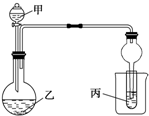 用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项正确的是( )
用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项正确的是( )| 甲 | 乙 | 丙 | 试管中的现象 | |
| A | 浓盐酸 | 二氧化锰 | 石蕊试液 | 先变红后褪色 |
| B | 醋酸 | 粉状贝壳 | Na2SiO3溶液 | 无浑浊 |
| C | 浓氨水 | 生石灰 | AlCl3溶液 | 无明显现象 |
| D | 浓硝酸 | 铜 | 水 | 生成无色气体并在试管口变为红棕色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水 | B. | Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | MgCl2溶液中加入过量氨水 | D. | MgSO4溶液中加入过量KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | II A | IIIA | IVA | VA | VIA | VⅡA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
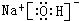 或
或 等.
等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com