
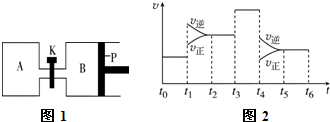
分析 (1)一定条件下,充入2.0mol SO2(g) 和1.0mol O2(g),20s后达平衡,测得SO3的体积分数为50%,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
变化量(mol):2x x 2x
平衡量(mol):2-2x 1-x 2x
故$\frac{2x}{3-x}$=50%,解得x=0.6,再根据v=$\frac{△c}{△t}$计算v(SO2);
(2)计算平衡常数各物质浓度,根据K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$计算平衡常数;若降温平衡常数增大,则平衡正向移动,正反应为放热反应;
(3)若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中通入6molSO3达到的平衡为等效平衡,平衡时SO3的转化率不变,平衡时体积为通入2molSO3平衡时体积的3倍.
(4)t1时刻正逆速率都增大,平衡逆向移动,正反应为气体体积减小的放热反应,不能是增大压强,应是升高温度;
t6时保持压强不变向体系中充入少量He气,容器体积增大,反应体系压强减小,平衡向气体体积增大的方向移动.
解答 解:(1)一定条件下,充入2.0mol SO2(g) 和1.0mol O2(g),20s后达平衡,测得SO3的体积分数为50%,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
变化量(mol):2x x 2x
平衡量(mol):2-2x 1-x 2x
故$\frac{2x}{3-x}$=50%,解得x=0.6,容器容积为2L,则v(SO2)=$\frac{\frac{1.2mol}{2L}}{20s}$=0.03mol/(L.min),
故答案为:0.03;
(2)容器容积为2L,平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{(\frac{1.2}{2})^{2}}{(\frac{0.8}{2})^{2}×\frac{0.4}{2}}$=11.25,若降温平衡常数增大,则平衡正向移动,正反应为放热反应,故△H<0,
故答案为:11.25;<;
(3)若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中通入6molSO3达到的平衡为等效平衡,平衡时SO3的转化率不变,平衡时体积为通入2molSO3平衡时体积的3倍,则平衡时总体积为1.25aL×3=3.75aL,故B的体积为3.75aL-aL=2.75a L,
故答案为:2.75a;
(4)t1时刻正逆速率都增大,平衡逆向移动,正反应为气体体积减小的放热反应,不能是增大压强,应是升高温度;
t6时保持压强不变向体系中充入少量He气,容器体积增大,反应体系压强减小,平衡向逆反应方向移动,即向左移动,
故答案为:升高温度;向左.
点评 本题考查化学平衡计算与衡影响因素、反应速率计算、平衡常数等,(3)中关键是对等效平衡思想的理解应用,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 71 | B. | 71 g•mol-1 | C. | 28.4 | D. | 28.4 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )| A. | a:Cl-b:K+ c:CO32- d:HCO3- | |
| B. | a:K+ b:CO32- c:Cl- d:HCO3- | |
| C. | a:K+ b:CO32- c:HCO3- d:Cl- | |
| D. | a:K+ b:HCO3- c:Cl- d:CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
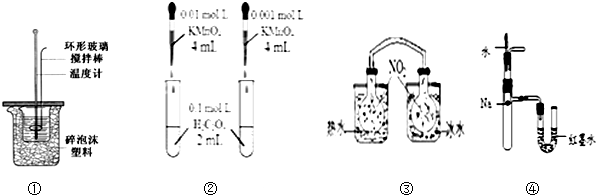
| A. | 装置①用于测定中和热装置 | |
| B. | 装置②依据褪色快慢比较浓度对反应速率的影响 | |
| C. | ③依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| D. | 装置④依据U管两边液面的高低判断Na和水反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用图示的装置进行电解,通电一段时间后,发现Pt电极上有气泡冒出.
用图示的装置进行电解,通电一段时间后,发现Pt电极上有气泡冒出.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| C. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| D. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com