
【题目】在室温下,同种规格的铝片分别与下列物质混合,化学反应速率最大的是( )
A. 0.1 mol L1的盐酸15 mL B. 0.2 mol L1的盐酸12 mL
C. 0.15 mol L1的硫酸溶液8 mL D. 18 mol L1的浓硫酸15 mL
科目:高中化学 来源: 题型:
【题目】工业上利用脱硫后的天然气合成氨的某流程如下:
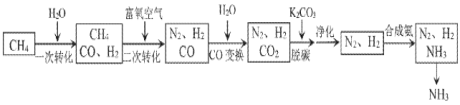
(1)“一次转化”中H2O(g)过量的目的是______。
(2)已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(g)△H=-484kJmol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJmol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJmol-1
“二次转化”时CH4和O2反应生成CO和H2的热化学方程式为______。
(3)“CO变换”的反应是CO(g)+H2O(g)CO2(g)+H2(g)某温度下,该反应的平衡常数K=1,若要使CO的转化率达到90%,则起始时c(H2O):c(CO)应不低于______。
(4)“脱碳”后的溶液再生的方法是______(以化学方程式表示)。
(5)“净化”时发生的反应为 [Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)[Cu(NH3)3CO]Ac(aq),△H<0。充分吸收CO采取的措施是______(选填序号)。
a 升温b 降温c 加压d 减压
(6)已知N2(g)+3H2(g)2NH3(g)△H<0,平衡时NH3的物质的量分数c(NH3)与氢氮比x(H2与N2的物质的量比)的关系如图:
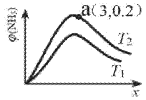
①T1______T2(填“>”、“=”或“<”)。
②a点总压为50Mpa,T2时Kp=______(Mpa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③实验测得一定条件下合成氨反应的速率方程为v=kc(N2)c1.5(H2)c-1(NH3)。以下措施既能加快反应速率,又能提高H2平衡转化率的是______
a 加压b 使用催化剂c 增大氢氮比d 分离NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾制备流程如图所示,下列有关说法不正确的是( )
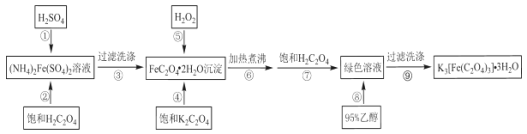
A.在步骤①中加入少量硫酸的目的是防止硫酸亚铁铵的水解,提高草酸亚铁的纯度
B.FeC2O42H2O转化为绿色溶液的离子方程式为:2FeC2O42H2O+H2O2+3C2O42-+H2C2O4=2[Fe(C2O4)3]3-+3H2O
C.在步骤⑥中加热煮沸的目的是为了加快H2O2将亚铁充分氧化为三价铁
D.步骤③与⑨洗涤沉淀的洗涤剂分别可为蒸馏水、无水乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应平均速率为0.3 mol·L-1·s-1 ②2s时物质B的浓度为0.7 mol·L-1③用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 ④2s时物质A的转化率为70%,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应平均速率为0.3 mol·L-1·s-1 ②2s时物质B的浓度为0.7 mol·L-1③用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 ④2s时物质A的转化率为70%,其中正确的是
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
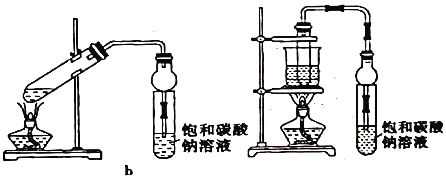
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
完成下列填空:
(1)实验时,试剂加入顺序是_____;通常加入过量的乙醇,原因是_____。
(2)加入数滴浓酸即能起催化作用,实际用量多于催化量,因为浓H2SO4能吸收生成的水,但浓硫酸用量又不能过多,原因是_____
(3)饱和Na2CO3溶液的作用是_____,_____。
(4)写出乙酸乙酯在NaOH溶液中加热的化学方程式_____。
(5)若用b装置制备乙酸乙酯其缺点_____。
(6)由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,分离乙酸乙与该杂质的方法是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家合成出了一种由W、X、Y、Z组成的新化合物(如图所示)。W、X、Y、Z为同一短周期元素,W元素焰色为黄色,水体中Y元素含量高会导致水体富营养化,Z的单质常用于给自来水消毒,其核外最外层电子数是X核外电子数的一半。
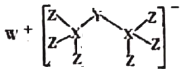
据此回答下列问题:
(1)X在周期表中的位置为_____。
(2)W、Y、Z形成的简单离子半径从大到小的顺序为_____(用离子符号表示)
(3)Y所在主族的元素形成的最简单氢化物,沸点最低的为_____(填化学式),YZ3中所含化学键为_____ (填“离子键”或“共价键”)
(4)写出证明非金属性Z大于X的判据_____ (任写一条)
(5)实验室中制备Z的单质的离子反应方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的量和摩尔质量的叙述,正确的是 ( )
A. 水的摩尔质量是18 g
B. 0.012 kg 12C中约含有6.02![]() 1023个碳原子
1023个碳原子
C. 1 mol水中含有2 mol氢和1 mol氧
D. 1 mol任何物质都含有6.02![]() 1023个分子
1023个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
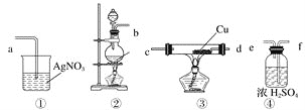
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com