
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
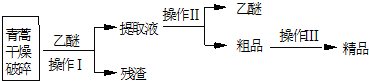
分析 将青蒿干燥剪碎可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品加95%的乙醇,浓缩、结晶、过滤可得精品,
(1)反应物接触面积越大,其反应速率越快;
(2)分离难溶性固体和溶液采用过滤方法;分离互溶的液体采用蒸馏方法;
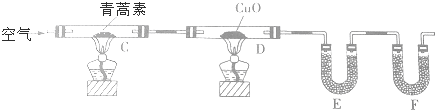
(3)①C中青蒿素在加热条件下反应生成碳的氧化物和水,如果生成物中含有CO,CO能还原CuO生成二氧化碳,用E中物质吸收水蒸气,且E中物质不能和二氧化碳反应,且为固体,应该为酸性干燥剂;F用来吸收二氧化碳,且为碱性固体物质;
②在F后应再加入一个装置防止外界空气中CO2,和H2O进入的装置;左侧通入的空气中含有二氧化碳和水蒸气;
③由数据可知 m(H2O)=42.4g-22.6g=19.8g,所以n(H2O)=1.1mol
m(CO2)=146.2g-80.2g=66g,所以 n(CO2)=1.5mol
所以青蒿素中氧原子的质量为m(O)=28.2-(2.2×1)-(1.5×12)=8g,所以n(O)=0.5mol,
根据C、H、O原子物质的量之比确定最简式;
(4)酯难溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠.
解答 解:青蒿干燥剪碎可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品加95%的乙醇,浓缩、结晶、过滤可得精品,
(1)反应物接触面积越大,其反应速率越快,将青蒿素破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,
故答案为:增大青蒿与乙醚的接触面积,提高青蒿素的浸取率;
(2)分离难溶性固体和溶液采用过滤方法;分离互溶的液体采用蒸馏方法,所以操作I是过滤、操作II是蒸馏,
故答案为:过滤;蒸馏;
(3)①C中青蒿素在加热条件下反应生成碳的氧化物和水,如果生成物中含有CO,CO能还原CuO生成二氧化碳,用E中物质吸收水蒸气,且E中物质不能和二氧化碳反应,且为固体,应该为酸性干燥剂;F用来吸收二氧化碳,且为碱性固体物质,
所以E中物质为无水CaCl2或P2O5、F中物质为碱石灰,
故答案为:无水CaCl2或P2O5;碱石灰;
②在F后应再加入一个装置防止外界空气中CO2,和H2O进入的装置,左侧通入的空气中含有二氧化碳和水蒸气,其改进方法为:除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置,
故答案为:除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置;
③由数据可知 m(H2O)=42.4g-22.6g=19.8g,所以n(H2O)=1.1mol,根据H原子守恒的n(H)=2n(H2O)=2.2mol,
m(CO2)=146.2g-80.2g=66g,所以 n(CO2)=1.5mol,根据C原子守恒得n(C)=n(CO2)=1.5mol,
所以青蒿素中氧原子的质量为m(O)=28.2-(2.2×1)-(1.5×12)=8g,所以n(O)=0.5mol,
C、H、O原子物质的量之比=1.5mol:2.2mol:0.5mol=15:22:5,
所以其最简式为C15H22O5,故答案为:C15H22O5;
(4)由于酯都难溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠结合题意可知,青蒿素中含有酯基,故选C.
点评 本题考查制备实验方案设计,为高频考点,涉及实验操作、物质的量计算、有机物性质等知识点,明确实验原理、物质性质、实验基本操作是解本题关键,注意对实验的评价,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2溶液 | B. | AgNO3溶液 | C. | H2SO4溶液 | D. | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
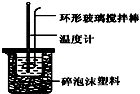 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 起始温度t1/℃ | 终止温度t2/℃ |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
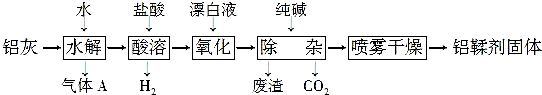
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S>O>F | B. | S2->Cl->K+>Ca2+ | C. | F->O2->Na+>Mg2+ | D. | Fe>Fe2+>Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com