
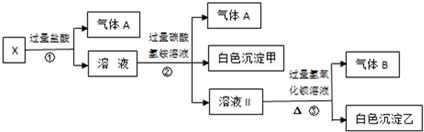
| A. | 气体A是CO2,白色沉淀甲是氢氧化铝 | |
| B. | 溶液中一定不含Ag+、Fe3+、SO42- | |
| C. | 溶液Ⅱ是硫酸钠、碳酸氢铵、氯化钠的混合物 | |
| D. | 溶液中一定存在的离子有Na+、CO32-、AlO2-和SO42- |
分析 溶液呈无色,则不含Fe3+,加入过量盐酸只产生气体,则一定含有CO32-,不含Ag+;反应后溶液呈酸性,加入过量碳酸氢铵溶液,生成气体和白色沉淀,则发生反应应为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,则原溶液中含有AlO2-,则一定不含Ag+、Ba2+、Al3+,因这些离子与AlO2-发生相互促进的水解而不能大量共存,根据溶液电中性原则,一定含有Na+;最后加入过量氢氧化钡溶液,因之前加入的碳酸氢铵过量,则生成的白色沉淀可能为BaCO3,不能确定是否含有SO42-,据此对各选项进行解答.
解答 解:无色溶液中不含Fe3+,加入过量盐酸只产生气体,则一定含有CO32-,不含Ag+;反应后溶液呈酸性,加入过量碳酸氢铵溶液,生成气体和白色沉淀,则发生反应应为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,则原溶液中含有AlO2-,根据离子共存一定不含Ag+、Ba2+、Al3+,因这些离子与AlO2-发生相互促进的水解而不能大量共存;根据溶液电中性原则,一定含有Na+,最后加入过量氢氧化钡溶液,因之前加入的碳酸氢铵过量,则生成的白色沉淀可能为BaCO3,无法确定是否存在SO42-,
A、根据分析可知,气体A为CO2,白色沉淀甲为氢氧化铝,故A正确;
B、溶液中一定不含Fe3+、Ag+、Ba2+、Al3+,无法确定是否存在SO42-,含有CO32-、Na+、AlO2-,故B错误;
C、溶液Ⅱ中不一定含有硫酸根离子,故C错误;
D、溶液中一定含有CO32-、Na+、AlO2-,无法确定是否存在SO42-,故D错误.
故选A.
点评 本题考查常见离子的检验及离子组成分的确定,题目难度中等,注意常见离子的检验方法,把握有关离子的性质为解答关键,试题有利于培养学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
| A. | Na→NaOH→NaHCO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Fe→Fe(OH)2→FeCl2→FeCl3 | D. | Si→SiO2→H2SiO3→Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
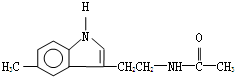
| A. | 其官能团和营养成分与葡萄糖相同 | |
| B. | 其分子式为C13H15N2O | |
| C. | 该物质不能与溴的四氯化碳溶液反应 | |
| D. | 该物质能发生水解反应并生成乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在盛有硫酸亚铁铵溶液的试管中,滴加几滴新制氯水,无明显现象,然后滴加KSCN溶液,若观察到溶液变为血红色,则说明硫酸亚铁铵中含有Fe2+ | |
| B. | 测量某溶液的pH,pH试纸一旦用水湿润,一定会产生实验误差 | |
| C. | 灼烧海带可以在坩埚中进行,也可以在蒸发皿中进行 | |
| D. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
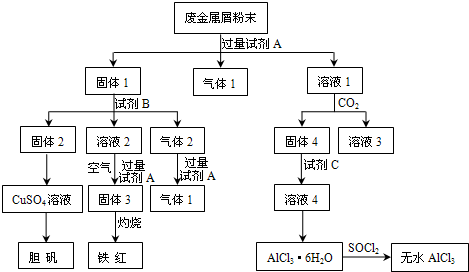
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C16H30O2 | B. | C17H26O4 | C. | C18H28O2 | D. | C17H28O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com