


科目:高中化学 来源: 题型:
+ 2 |
- 6 |
+ 2 |
- 6 |
+ 4 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
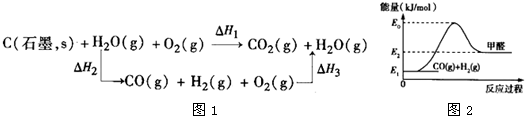
查看答案和解析>>
科目:高中化学 来源: 题型:
C、S、O、Se是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为![]()
![]()
![]()
![]()
![]()

![]()
![]()
(2)C、Si、Sa三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SO2晶体的空间构型及硅氧之间的成键方式 ;
 ③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
(4)CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-3,CO分子中碳氧键的伸缩振动频率为2143cm-2,则Ni(CO)中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A.强
B.弱
C.相等
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
C、S、O、Se是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为![]()
![]()
![]()
![]()
![]()
![]()
![]()
(2)C、Si、Sa三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
(4)CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-3,CO分子中碳氧键的伸缩振动频率为2143cm-2,则Ni(CO)中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A.强
B.弱
C.相等
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
C、S、O、Se是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)Ge的原子核外电子排布式为
(2)C、Si、Sa三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
(4)CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-3,CO分子中碳氧键的伸缩振动频率为2143cm-2,则Ni(CO)中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A.强
B.弱
C.相等
D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com