
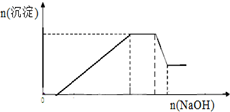
 已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]分析 加入过量的稀盐酸,无沉淀生成,说明溶液中一定不存在Ag+;
继续加入过量的稀硫酸,有白色沉淀生成,白色沉淀为硫酸钡,原溶液中一定存在Ba2+,则一定不存在SO42-,根据溶液电中性可知,一定存在NO3-;
根据图象可知,加入氢氧化钠溶液后沉淀逐渐增加,然后不变,最后部分溶解,所以一定存在Fe2+、Al3+、NH4+,加热溶液产生使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,说明溶液中一定存在铵根离子;无法确定溶液中是否存在钾离子,根据以上分析进行解答.
解答 解:(1)加入过量的稀盐酸无沉淀生成,说明溶液中一定不存在与Cl-反应的Ag+;继续加入过量的稀硫酸,有白色沉淀生成,白色沉淀为BaSO4,原溶液中一定存在Ba2+,则一定不存在与Ba2+反应的SO42-,根据溶液电中性可知,一定存在唯一的阴离子NO3-;根据图象可知,加入NaOH溶液后沉淀逐渐增加,然后沉淀的量不变,最后有部分溶解,所以原溶液中一定存在Fe2+、Al3+、NH4+,加热溶液产生使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,说明溶液中一定存在NH4+,
根据以上分析可知,溶液中一定存在的离子为:Fe2+、Al3+、Ba2+、NH4+、NO3-;一定不存在的离子为:SO42-、Ag+,不能确定K+是否存在,
故答案为:Fe2+、Al3+、Ba2+、NH4+、NO3-;SO42-、Ag+;
(2)所以pH试纸检测定溶液pH的方法为:取一片pH试纸置于表面皿上,用洁净的玻璃棒蘸取待测液,点在pH试纸的中部,与标准比色卡对照,判断溶液是否呈碱性,
故答案为:取一片pH试纸置于表面皿上,用洁净的玻璃棒蘸取待测液,点在pH试纸的中部,与标准比色卡对照,判断溶液是否呈碱性;
(3)使湿润红色石蕊试纸变蓝色的气体为氨气,该反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
溶液中含有亚铁离子,亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁在加热过程中被氧化成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查了常见离子的检验方法,题目难度中等,要求学生熟练掌握常见离子的检验方法,注意掌握某些离子的特殊性质,如能够使湿润的红色石蕊试纸变蓝的气体为为氨气;本题中硝酸根离子的判断为易错点,注意溶液电中性的应用.


科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同容下,两种气体的质量之比等于压强之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
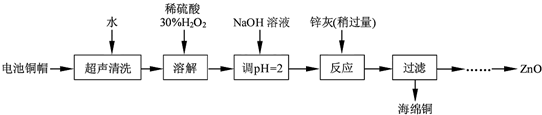
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为1mol•L-1 | |
| B. | 2.3g钠转化为钠离子时得到的电子数目为0.1NA | |
| C. | 常温常压下,11.2L 甲烷中所含的氢原子数为2NA | |
| D. | 32g O2和O3混合气体所含的原子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com