
| A. | n-3 | B. | n-1 | C. | n+5 | D. | n+2 |
分析 化合物Y2X3,则Y元素的化合价为+3价,X元素的化合价为-2价,则Y可能为B或Al元素,X可能为O或S元素,还存在特殊情况为Y为N元素,X为O元素形成的化合物.
解答 解:A.若化合物Y2X3为B2O3,B的核电荷数为5,O的为8,已知X的核电荷数为n,则Y的核电荷数为n-3,故A不选;
B.若化合物Y2X3为N2O3,N的核电荷数为7,O的为8,已知X的核电荷数为n,则Y的核电荷数为n-1,故B不选;
C.若化合物Y2X3为Al2O3,Al的核电荷数为13,O的为8,已知X的核电荷数为n,则Y的核电荷数为n+5,故C不选;
D.无论什么情况,已知X的核电荷数为n,则Y的核电荷数不可能为n+2,故D选;
故选D.
点评 本题考查学生利用化合价与化学式及核电荷数的关系,学生应熟悉常见的化合物中的元素的化合价及元素的核电荷数,能利用举例的方法或价序原则来分析解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原硅酸是白色胶状物,失去部分水后变成白色粉末状硅酸 | |
| B. | SiO2分子由一个硅原子和两个氧原子构成 | |
| C. | SiO2溶于水后则慢慢生成硅酸 | |
| D. | SiO2既能与酸反应,又能与强碱反应,故它是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
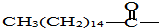 后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味便消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 无味氯霉素的水溶性变差,所以苦味消失 | |
| B. | 无味氯霉素失去了药性,所以苦味消失 | |
| C. | 无味氯霉素是棕榈酸的盐类 | |
| D. | 无味氯霉素在人体内不会发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
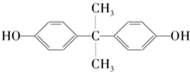
| A. | 1 mol该物质与足量溴水反应消耗2 mol Br2 | |
| B. | 该物质能与碳酸氢钠溶液反应放出CO2 | |
| C. | 该物质的所有碳原子可能在同一平面 | |
| D. | 该物质与足量氢气发生加成反应后所得物质的化学式为C15H28O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3( CH2)2 CH3 和 CH3 CH=CH CH3 | |
| B. | CH3( CH2)2 CH3 和 CH3 CH2 CH( CH3) CH2 CH3 | |
| C. | CH3 C≡C CH3 和CH2=CH CH=CH2 | |
| D. | CH3 C≡C CH3 和 CH3 CH=CH CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
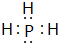 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
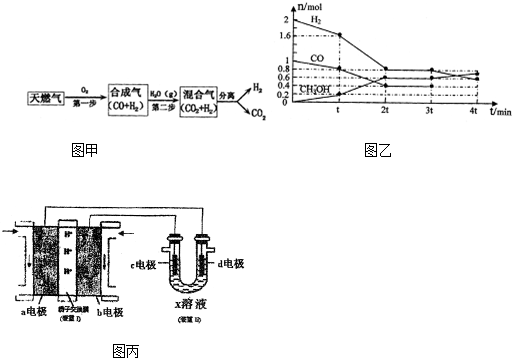
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | |
| C. | c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+ | |
| D. | c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 2.5mol | C. | 0.15mol | D. | 1.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com