
分析 根据烷烃的通式CnH2n+2来计算,按碳链异构写出烷烃的同分异构体.根据烷烃燃烧通式为CnH2n+2+$\frac{3n+1}{2}$O2$\frac{点燃}{\;}$nCO2+(n+1)H2O确定消耗氧气.
解答 解:某烷烃的相对分子质量为72,烷烃的通式CnH2n+2,则14n+2=72,解得n=5,所以该烷烃的分子式为C5H12,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的: ,
,
主链有3个碳原子的: ;
;
1mol该C5H12完全燃烧需消耗氧气为1mol×$\frac{3×5+1}{2}$=8mol,
故答案为:3种;8.
点评 本题考查有机物分子式确定、同分异构体书写、烷烃的命名,比较基础,注意利用组成通式确定分子式,掌握烷烃同分异构体书写.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
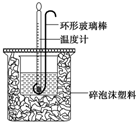 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃[来源:Z,xx,k.Com] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 20.5 | 20.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
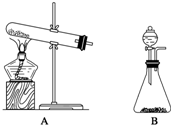 氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:
氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
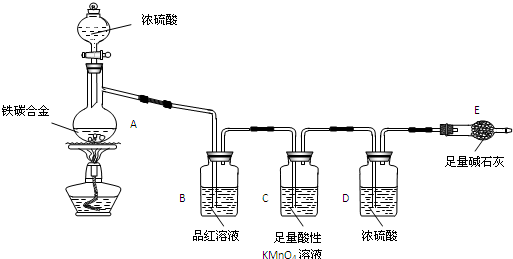
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于冰中的水分子间存在氢键,所以其密度大于液态水 | |
| B. | 可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大 | |
| C. | 分子间氢键和分子内氢键都会使熔沸点升高 | |
| D. | 每一个水分子内平均含有两个氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L 的Na2CO3溶液中,含有的Na+离子数为2 NA | |
| B. | 0.5 mol H2SO4含有的原子数目为3.5NA | |
| C. | 32 g O2所含的分子数目为NA | |
| D. | 27g金属铝变成铝离子时失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 指示剂 | 变色范围 | 酸色 | 碱色 |
| 石蕊 | 5.0-8.0 | 红色 | 蓝色 |
| 酚酞 | 8.0-10.0 | 无色 | 红色 |
| 甲基橙 | 3.1-4.4 | 红色 | 黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导致易拉罐变瘪的离子反应是:CO2+OH-═HCO3- | |
| B. | 导致易拉罐又鼓起来的反应是:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| C. | 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 | |
| D. | 反应结束后,易拉罐内溶液中的溶质只有Na[Al(OH)4] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com