
| A. | 单位时间内生成n mol A,同时生成n mol D | |
| B. | B的浓度保持不变 | |
| C. | 容器内混合气体的密度不随时间而变化 | |
| D. | 单位时间内消耗n mol B,同时消耗n mol A |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、单位时间里生成n mol A即消耗0.5nmolD,同时生成n mol D,正逆反应速率不相等,所以不能说明到达平衡状态,故A错误;
B、化学反应达到平衡状态时,各物质的物质的量不变,百分含量不变,所以B的浓度保持不变,能说明到达平衡状态,故B正确;
C、混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,气体的密度不随时间改变,不能说明到达平衡状态,故C错误;
D、单位时间内消耗n mol B,同时消耗n mol A,都表示正反应速率,反应始终二者都按1:1进行,所以不能说明到达平衡状态,故D错误;
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大,本题注意反应可逆的特点,注意正逆反应速率是否相等的判断.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成单质的分子内一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 测化合物在熔融或水溶液中的导电性可判断是否为离子化合物 | |
| D. | 化学反应中伴随的能量变化,所以反应一定会有热效应(即放热成吸热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. .
. ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件): .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
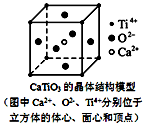
| A. | 分子晶体中都存在共价键 | |
| B. | 右图CaTiO3晶体中每个Ti4+与12个O2-相紧邻 | |
| C. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| D. | 在二氧化硅晶体中,最小环上的原子个数是六 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 200℃时,反应从开始到平衡的平均速率 v(A)=0.08 mol•L-1•min-1 | |
| B. | 若 0~5 min 时容器与外界的热交换总量为 m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol | |
| C. | 200℃时,若在第 6 min 再向体系中加入催化剂,可使 v 正>v 逆 | |
| D. | 200℃时,平衡后再充入 2 mol C,则达到平衡时,化学平衡常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
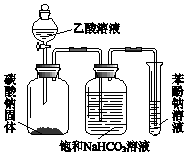 某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.
某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com