
| A.①④ | B.②③⑤ | C.①③ | D.①②④ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.石墨比金刚石更稳定 |
| B.金刚石的能量比石墨的低 |
| C.金刚石比石墨稳定 |
| D.金刚石和石墨不能相互转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应中肼作还原剂 |
| B.液态肼的燃烧热为20.05kJ?mol-1 |
| C.该动力源的突出优点之一是生成物对环境污染小 |
| D.肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+C(g),若A的浓度由0.1 mol·L
2B(g)+C(g),若A的浓度由0.1 mol·L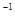 降到0.06 mol·L
降到0.06 mol·L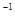 需20 s,那么由0.06 mol·L
需20 s,那么由0.06 mol·L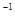 降到0.024 mol·L
降到0.024 mol·L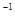 需要的时间
需要的时间查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
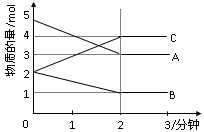
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是| A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1 |
| B.达平衡时压强变为原来的7/6 |
| C.此温度下该反应的平衡常数为0.005 |
| D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
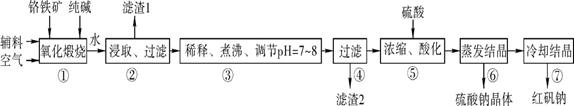
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2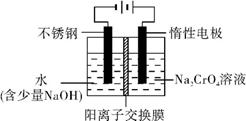
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com