
| 选项 | 物质 | 杂质 | 除杂试剂 | 反应条件或除杂方法 |
| A | 苯 | 乙酸 | 烧碱溶液 | 分液 |
| B | 硅 | 铝 | 稀盐酸 | 过滤 |
| C | 氯气 | 氯化氢 | 饱和食盐水 | 洗气 |
| D | 乙烷 | 乙烯 | 氢气 | 催化剂、加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯不溶于水,乙酸与氢氧化钠溶液发生中和反应;
B.铝于稀盐酸反应;
C.氯气难溶于饱和食盐水;
D.易引入新杂质.
解答 解:A.苯不溶于水,乙酸与氢氧化钠溶液发生中和反应,反应后可用分液的方法分离,故A正确;
B.硅与盐酸不反应,且不溶于水,铝于稀盐酸反应,可用过滤的方法分离,故B正确;
C.氯气难溶于饱和食盐水,而氯化氢易溶于水,可用洗气的方法分离,故C正确;
D.实验室难以完成,且不能确定乙烯的含量,易引入新杂质,故D错误.
故选D.
点评 本题考查物质的分离提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同以及实验的合理性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为: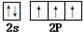 .
.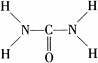 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9gD2O中含有的电子数为5NA | |
| B. | 4.5gSiO2晶体中含有的硅氧键的数目为0.15NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 氯化铁溶液腐蚀铜线路板Cu+Fe3+=Cu2++Fe2+ | |
| C. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 氯气溶于水:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | NH4HCO3溶液中加入过量的NaOH溶液并加热:HCO3-+OH+$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+H2O | |
| C. | 稀硝酸除银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2═2Fe3++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com