
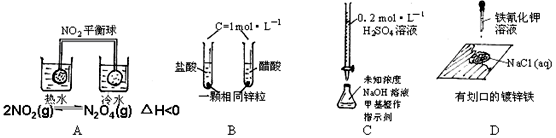
| 序号 | 实验现象 | 结 论 |
| A | 热水中平衡球颜色比冷水中深 | 升温,化学平衡向吸热反应方向移动 |
| B | 起始时产生气泡速率HCl > CH3COOH | 醋酸是弱电解质 |
| C | 溶液颜色由黄变橙,且30秒内不变色 | 已达滴定终点 |
| D | 划口处有蓝色沉淀 | 铁发生了析氢腐蚀 |
科目:高中化学 来源:不详 题型:单选题
| A.由H2、I2、HI组成的平衡体系加压后颜色变深 |
| B.黄绿色的氯水光照后颜色变浅 |
| C.使用催化剂可加快SO2转化为SO3的速率 |
| D.将木炭粉碎后与O2反应,速率更快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
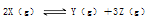
 向___(填“左”“右”或“不”,下同)移动;若将达到(1)的平衡体系中移走部分混合气体,则平衡向___移动。
向___(填“左”“右”或“不”,下同)移动;若将达到(1)的平衡体系中移走部分混合气体,则平衡向___移动。| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),在已达到平衡后的反应容器中充入少量18O2,一段时间后18O存在于:
2SO3(g),在已达到平衡后的反应容器中充入少量18O2,一段时间后18O存在于:| A.O2 | B.O2和SO2 | C.O2和SO3 | D.SO2、O2和SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见表。下列说法正确的是
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见表。下列说法正确的是 | 温度 | 平衡浓度/ (mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | | 0.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2(g)+I2(g)达到平衡后,下列说法中,正确的是:
H2(g)+I2(g)达到平衡后,下列说法中,正确的是:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2SO2+O2=2SO3(g)△H<0 | B.4NH3+5O2=4NO+6H2O(g)△H<0 |
| C. 2NH3=N2+3H2△H>0 | D.SO2+NO2=SO3(g)+NO△H<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g);△H<0。该反应的速率与时间的关系如下图所示:
2C(g);△H<0。该反应的速率与时间的关系如下图所示: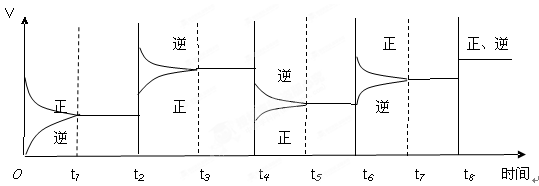
| A.降低温度、增大压强、减小反应物浓度、使用了催化剂 |
| B.使用了催化剂、增大压强、增大反应物浓度、升高温度 |
| C.增大反应物浓度、使用了催化剂、减小压强、升高温度 |
| D.升高温度、减小压强、增大反应物浓度、使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。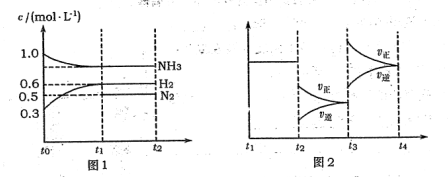
| A.容器内压强不再发生变化 | B.N2的体积分数不再发生变化 |
| C.容器内气体质量不再发生变化 | D.容器内气 体密度不再发生变化 体密度不再发生变化 |
 。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com