
| 组别 | 实验温度 (℃) | H2O2溶液 | FeCl3溶液 (1mol/L) |
| 1 | 30 | 5mL 4% | 1mL |
| 2 | 60 | 5mL 4% | 1mL |
| 3 | 30 | 5mL 12% | |
| 4 | 30 | 5mL 4% |
分析 (1)通过比较表格中的数据的异同点进行解答,根据控制变量法来分析研究的对象;
(2)提供催化剂,加快反应速率,现象更为明显;
(3)实验3两试管中双氧水的浓度相同,有一支试管中加入了氯化铁溶液,氯化铁作催化剂,则可知实验3的目的;加入的1mL溶液会对乙试管溶液进行稀释,会使浓度发生改变.
解答 解:(1)实验1、2只有温度不同,所以研究的是温度对反应速率的影响,
故答案为:1、2;
2)向试管甲中加入5mL12%H2O2溶液,向试管乙中加入5mL4%H2O2溶液,再同时分别向试管甲和试管乙中滴加2~3滴lmol/LFeCl3溶液作为催化剂,加快反应速率,现象更为明显,故改进方法是再同时分别向试管甲和试管乙中滴加2~3滴lmol/LFeCl3溶液作为催化剂,
故答案为:再同时分别向试管甲和试管乙中滴加2~3滴lmol/LFeCl3溶液作为催化剂;
(3)只有一支试管中加入了氯化铁溶液,与另一支试管形成对比试验,则实验目的是探究催化剂对化学反应速率的影响;但此方案设计不合理,因为加入的1mL溶液会对试管溶液进行稀释,使浓度发生改变,
故答案为:探究催化剂对化学反应速率的影响;否;试管中加入1mL1mol/LFeCl3溶液会使H2O2溶液的浓度降低.
点评 本题考查了探究影响反应速率的因素,实验方案的设计,难度一般,注意试验过程中单一变量研究方法的使用,为易错点.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 检验淀粉已完全水解;在淀粉水解液中滴加碘水 | |
| B. | 证明氧化性H2O2比Fe3+强,将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | |
| C. | 检验某溶液中含Fe2+:可先向溶液中加入氯气,再滴加少量KSCN溶液 | |
| D. | 把0.9mol•L-1硫酸100mL;将18 mol•L-1硫酸5mL移入100mL容量瓶,加水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,NaTi2(PO4)3发生氧化反应 | |
| B. | 放电时,Na+向锌棒一极移动 | |
| C. | 充电时,阳极反应式为[Ti2(PO4)3]+-2e-=[Ti2(PO4)3]3+ | |
| D. | 充电时,每转移0.2 mol电子,阴极增重6.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:Y>X | |
| B. | 最简单气态氢化物的稳定性:W>X | |
| C. | 化合物WX、YZ中化学键类型相同 | |
| D. | W、Z的最高价氧化物对应的水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
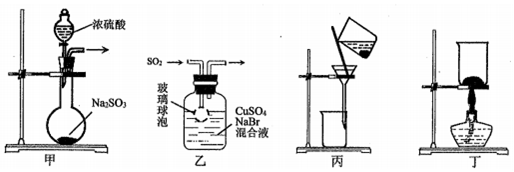
| A. | 用装置甲制取SO2 | B. | 用装置乙制取CuBr | ||
| C. | 用装置丙避光将CuBr与母液分离 | D. | 用装置丁干燥CuBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H>0 | |
| B. | 等pH的CH3COOH、HCl溶液混合后,平衡不移动,但c(CH3COO-)减少 | |
| C. | 配制KF溶液时,必需要加入KOH溶液抑制F-水解 | |
| D. | 向NaHS溶液中滴入少量CuCl2溶液产生黑色沉淀,HS-电离程度增大,pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b+c时,B的物质的量分数变大 | B. | 若a=b+c时,B的体积分数不变 | ||
| C. | 若a>b+c时,A的转化率变小 | D. | 若a<b+c时,A的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2与SO3互为同分异构体 | |
| B. | 氢气是理想的绿色能源 | |
| C. | 单质中不存在化学键 | |
| D. | 电解饱和氯化钠溶液可能得到金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 可以通过延长化学反应时间改变化学反应限度 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度不再改变 | |
| D. | 化学反应的限度不可以通过改变条件而发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com