
分析 (1)依据①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
由盖斯定律$\frac{①}{3}$-$\frac{②}{3}$计算分析判断;
(2)从熵变和焓变判断反应的自发性,该反应是气体体积增大的吸热反应,为提高CO的产率,依据化学平衡移动原理分析判断;
(3)①由题意吸收低浓度的CO2,则应生成正盐(NH4)2CO3 ;
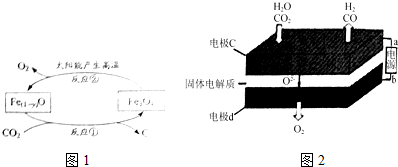
②依据图1反应物和产物利用直平法配平化学方程式,利用已知守恒计算得到;
③水电解产生氢气,电极反应为H2O+2e-═H2+O2-,后反应为H2+CO2═H2O+CO,根据电极反应式可得电解得到1:1的合成气(CO+H2)通入的CO2和H2O物质的量之比.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
由盖斯定律$\frac{①}{3}$-$\frac{②}{3}$得到C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1,
故答案为:+172.5;
(2)由题第一步:2CH3OH(g)?HCOOCH3(g)+2H2(g);第二步:HCOOCH3(g)?CH3OH(g)+CO(g),两反应均为气体体积增大的反应,则两反应都△S>0,常温下不能自发,故△H>0,第二步:HCOOCH3(g)?CH3OH(g)+CO(g)△H>0,反应是气体体积增大的吸热反应,依据平衡移动原理可知提高一氧化碳产率,应使平衡正向进行,升温,减压实现,
故答案为:两反应都△S>0,常温下不能自发,故△H>0;升高反应温度或减小压强;
(3)①由题意吸收低浓度的CO2,则应生成正盐(NH4)2CO3 ,化学方程式为:2NH3•H2O+CO2=(NH4)2CO3+H2O;
故答案为:2NH3•H2O+CO2=(NH4)2CO3+H2O;
②依据图示得到化学方程式为:$\frac{(1-y)}{3}$Fe3O4=Fe(1-y)O+xO2,依据氧原子守恒得到x=$\frac{1-4y}{6}$,
故答案为:$\frac{1-4y}{6}$;
③水电解产生氢气,电极反应为H2O+2e-═H2+O2-,后反应为H2+CO2═H2O+CO;若要产生1:1的H2和CO,产生CO消耗等量的H2,故H2和CO物质的量比为2:1,所以通入的CO2和H2O物质的量比值为1:2;故答案为:H2O+2e-=H2+O2-;1:2.
点评 本题考查了盖斯定律的应用、化学平衡移动原理的应用,电解池电极反应的分析书写,原子守恒氧化还原反应的计算应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH3)CH2CH3 2-甲基丁烷 | B. |  间二甲苯 间二甲苯 | ||
| C. | CH3CH2CH2CH2OH 1-羟基丁烷 | D. | 2-甲基-2-丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
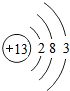 .
. .
. ,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是
,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是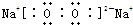 ,其晶体类型属于离子晶体.
,其晶体类型属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
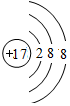 ,离子半径最大的是S 2-.
,离子半径最大的是S 2-.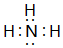 ;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为
;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为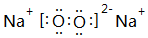 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应吸热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,则容器中可能使用了催化剂或恒温恒容下充入惰性气体 | |
| B. | 在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b | |
| C. | 若其他条件不变,升高温度,则a<b | |
| D. | 若保持温度、压强不变,充入惰性气体,则a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com